나노물질








단백질 당화는 증가된 당 수치로 인해 당뇨병 환자의 혈장에서 일어나는 주요 생화학적 사건입니다. 광범위한 당화는 당뇨병 환자에게 해로운 영향을 미치는 것으로 잘 알려진 진행성 당화 최종 생성물(AGE)의 형성으로 이어집니다. 현재 작업에서 우리는 생체 외에서 생리학적으로 중요한 단백질인 헤모글로빈 A0를 당화하여 GNP(금 나노 입자) 합성을 위한 템플릿으로 사용하여 AGE 형성 및 활성을 연구했습니다. 합성된 GNP의 표면 플라즈몬 공명은 당화 정도와 높은 상관관계를 나타내는 것으로 밝혀졌다. 분별 시 당화 헤모글로빈 A0는 두 개의 별개의 제품 집단으로 분리되었는데, 하나는 단백질성, 교차 결합된 헤모글로빈 A0의 더 큰 단편으로 구성되고 두 번째 집단은 비단백질성 저분자량 AGE로 구성됩니다. 저분자량 AGE만이 분획을 주형으로 사용할 때 GNP 합성에 기여하여 제안된 GNP 기반 분석의 원리를 입증합니다. 생리학적 중요성 때문에 AGE는 당뇨병 및 관련 합병증의 진단 수단으로 사용될 수 있습니다. 이 연구에서 우리는 GNP 기반의 새로운 비색 센서의 개발을 위해 AGEs의 높은 반응성을 사용하여 감지할 수 있도록 했습니다. 우리가 제안한 GNP 기반 감지는 당뇨병 및 관련 복잡성을 감지하는 데 임상적으로 높은 의미를 가질 수 있습니다.
<섹션 데이터-제목="배경">제2형 진성 당뇨병(T2DM)은 고혈당 수치의 존재를 특징으로 하는 복합 대사 장애입니다. 체내에 지속되는 고혈당은 일련의 화학적 및 생화학적 반응을 시작하며 고혈당이 진행되는 동안 발생하는 가장 중요한 반응은 가역성 알디민(Schiff 염기)을 형성하기 위해 당과 단백질 사이의 비효소적 반응을 포함하는 메일라드 반응으로 알려져 있습니다. 결합. 상대적으로 불안정한 쉬프 염기는 '아마도리 제품'으로 알려진 보다 안정적인 케토 형태로 호변이성화됩니다[1]. 당화 중간 산물 또는 초기 당화 산물이라고도 하는 Amadori 제품은 그룹 재배열, 고리화, 탈수, 분해 반응을 거쳐 다양한 화합물을 형성합니다. 이들 화합물은 단백질과 글리코실화제의 잠재적인 가교제로 알려져 있다[2]. 이들은 고급 당화 최종 생성물(AGEs)의 형성으로 이어지는 추가 분해에 민감합니다[3]. 높은 내인성 농도에서 AGE는 단백질 가교를 유도하거나 수용체 매개 세포내 신호 전달(RAGE)을 통해 당뇨병의 합병증에 기여하여 산화 스트레스와 염증을 유발합니다[5, 6]. 심혈관 질환[7, 8], 신장병[9, 10], 망막병[11, 12], 노화[13, 14], 관절염, 암[15,16,17], 신경퇴행성 질환과도 관련이 있는 것으로 알려져 있습니다. 알츠하이머[15] 및 우울증의 발병[18]과 같습니다. Maillard 반응 외에도 포도당 산화, 지질 과산화 및 폴리올 경로를 포함한 몇 가지 다른 경로도 생체 내에서 AGE의 형성을 유도합니다[19, 20]. 그 외에도 AGEs가 풍부한 것으로 알려진 특정 식품의 식이 섭취도 체내 총 AGEs에 기여합니다[6].
대부분의 AGE 생성물은 공통 구조 요소를 가지고 있지만[21], 수백 가지 AGE의 정확한 화학 구조는 아직 확인되지 않았습니다[22]. 이질성에도 불구하고 단백질과의 공유 교차 결합 형성과 '갈변 효과'는 알려진 모든 AGE에서 일반적입니다[23]. 당화의 초기 단계에서 형성되는 당 및 단백질을 포함하는 부가물을 초기 당화 부가물이라고 한다. Fructosyllysine과 Fructosamine은 이러한 구조의 예이며 잠재적인 가교제입니다[24,25,26]. 널리 연구된 AGE에는 N이(가) 포함됩니다. -카르복시메틸-리신(CML), N -카르복시에틸-리신(CEL)[27], 펜토시딘[28], 글루코스판[29], 피랄린, 아르그피라미딘, Crossline 및 Vesperlysine C[30].
당뇨병, 노화 및 관련 합병증의 진행에서 AGE의 역할에 대한 연구가 증가하고 있으며 각각의 연구에 대해 좋은 바이오마커로 보고되었습니다 [https://clinicaltrials.gov/ct2/show/NCT02863224][ 31,32,33,34]. 그러나 AGEs 구조의 복잡성과 이질성은 보편적인 검출 시스템 개발의 주요 장애물입니다[35]. AGE의 정성적 분석은 일반적으로 분광 및 비색 기술[36]을 통해 수행되며, 여기서 Maillard 반응 생성물의 진화는 초기 Maillard 반응 생성물[37]에 해당하는 280 nm에서 광 흡수의 향상을 측정하거나 측정함으로써 모니터링됩니다. 450 nm에서 형광 방출 [38,39,40,41,42]. 별개의 AGE 제품을 식별하기 위한 연구가 아직 진행 중입니다. 그러나 pentosidine[43]과 carboxymethyl lysine[44]의 정량을 위해 몇 가지 시도가 있었다. 대부분의 AGE는 다양한 폴리 및 모노클로날 항체를 사용한 면역조직화학 및 ELISA 기반 정량화에 의해 조직 수준에서 연구되었습니다[21, 45]. 현재까지 AGE 검출에 사용할 수 있는 최고의 분석 기술은 액체 또는 기체 크로마토그래피에 이어 분광광도계 또는 질량분석법 검출입니다[12, 46,47,48,49]. AGEs의 정량 분석은 여전히 주요 기술 과제이며 동일한 기술에 사용할 수 있는 몇 가지 기술은 비싸므로 현장 진료 응용 프로그램에서의 사용이 제한됩니다. AGEs의 정성적 및 정량적 평가를 위한 새로운 전략 개발은 생명을 위협하는 질병에 미치는 영향으로 인해 시급한 과제입니다.
감지의 단순성, 빠른 응답 시간 및 특히 생물학적 응용 분야의 비용 효율성으로 인해 비색 센서의 개발에 많은 노력을 기울였습니다[50]. 그 중 SPR(Surface Plasmon Resonance) 기반 센서는 높은 감지 감도로 인해 특히 관심을 받고 있습니다[51]. 현재 연구에서 우리는 AGE 제품의 정성적 식별을 위해 금 나노 입자(GNP)의 광학적 특성을 탐구했습니다. GNP는 고유하고 조정 가능한 SPR로 알려져 있으므로 다양한 생체 분자의 검출을 위한 비색 리포터로 진화했습니다. GNP에 기반한 광학 센서에는 작은 화학 분석물[52], 당[53], 다양한 단백질[54], 단백질 응집체[55] 및 단백질의 구조적 변형[56]에 대한 센서가 포함됩니다. 이전에 우리는 당화 단백질 주형에 접종했을 때 GNP가 당화 진행에 반응할 수 있음을 보여주었습니다[57]. 여기에서 우리는 AGE가 나타내는 환원 특성을 사용하여 비색법으로 다양한 당화 생성물의 정성적 검출을 위해 이 개념을 확장했습니다. 간단히 말해서, HbA0는 환원당으로 과당을 사용하여 시험관 내에서 당화되었고, AGE 형성 및 단백질 백본의 관련 구조적 변화가 분광기를 사용하여 확인되었습니다. 당화된 Hb를 겔여과 크로마토그래피를 사용하여 분획하여 생성물을 분자량에 따라 분리하고 얻어진 분획을 사용하여 GNP를 합성하였다. 비단백질성 AGE 제품만이 금 나노구조의 합성을 지시하여 식별이 가능합니다.
당뇨병, 노화, 알츠하이머, 신장 질환, 죽상 동맥 경화증 및 다양한 유형의 암을 포함한 질병에서 다양한 당화 산물의 관련성을 뒷받침하는 증거가 늘어나고 있습니다. 우리의 연구 결과는 당뇨병 관련 건강 합병증의 예후에 연루될 수 있는 다양한 AGE 제품을 식별하기 위한 간단하고 매우 민감한 비색 감지 플랫폼으로서 GNP의 사용을 강조합니다.
헤모글로빈 A0(HbA0) 및 Sephadex(G25)는 Sigma Aldrich India Pvt. Ltd. 사염화금수소(III) 삼수화물(HAuCl4 .3H2 O) Loba Chemie에서 구입했습니다. 과당, 오르토인산이수소칼륨, 오르토인산이칼륨, 오르토인산이수소나트륨, 오르토인산이나트륨, 페리시안화칼륨, 트리클로로아세트산, 염화제2철, 질산(HNO3 ), 염산(HCl), 아크릴아미드, 비스 아크릴아미드, 암모늄 퍼설페이트, TEMED, 나트륨 도데실 설페이트, Coomassie Brilliant Blue, 글리세롤, 디티오트레이톨, TRIS 염기 및 사용된 기타 화학물질은 분석 등급이었고 추가 정제 없이 사용되었습니다. 모든 실험에는 MilliQ 초순수(>18 MΩ)를 사용했습니다.
HbA0 및 과당의 스톡 용액은 고압멸균된 인산칼륨 완충액(0.1M, pH 7.4)에서 제조하고 사용하기 전에 0.2μm 주사기 필터를 사용하여 여과했습니다. HbA0 샘플을 37°C의 인큐베이터에서 다양한 시간(1~10일) 동안 다양한 농도의 과당과 함께 배양했습니다. 과당과 HbA0의 최종 농도는 0.1M 및 1mg mL -1 였습니다. 각기. HbA0 및 과당의 대조군도 동일한 농도로 유지되었습니다. 10일 동안 당화된 샘플에는 'Day 10'이라는 접두어가 붙고 배양되지 않은 대조군 샘플에는 'Day 0'이라는 접두어가 붙습니다. 모든 실험은 층류 공기 흐름 후드의 멸균 조건에서 수행되었습니다.
당화된 샘플의 환원 특성은 Gu가 설명한 방법에 의해 결정되었습니다. et al. [37] 약간의 수정이 있습니다. 그런 다음, 100μL의 당화된 샘플과 각각의 단백질 및 당 대조군을 1mL의 0.2M 인산나트륨 완충액 및 1mL 1% 페리시안화칼륨과 혼합했습니다. 혼합물을 20분 동안 수조에서 50°C에서 인큐베이션하였다. 혼합물을 실온으로 냉각시킨 후, 10% 트리클로로아세트산 1mL를 첨가하였다. 이 혼합물 1mL에 MilliQ 물 1mL 및 0.1% 염화 제2철 200μL를 첨가했습니다. 생성된 혼합물의 흡광도를 700 nm에서 측정하였다. 음성 대조군은 글리코실화된 샘플 대신에 0.1M 인산염 완충액이 첨가되었고 흡광도 측정을 위한 블랭크로 사용되었습니다. 700 nm에서 흡광도가 높을수록 환원성이 커집니다.
간단히 말해서, Sephadex(G25) 비드를 MilliQ 물에 밤새 담그고 15cm 길이, 1cm 직경 및 15mL 내부 부피의 유리 컬럼에 포장했습니다. 먼저 컬럼을 다량의 MilliQ 물로 세척한 다음 인산칼륨 완충액(0.1M, pH 7.4)으로 세척했습니다. Fruc-Hb 시료의 약 600μL를 phosphate buffer로 평형화시킨 후 컬럼에 로딩하였다. 동일한 완충액을 사용하여 시간당 7.5mL의 유속으로 용출을 수행하였다. 로딩된 샘플이 컬럼의 약 10cm 거리를 가로지르면 분획을 수집했습니다. 각 샘플에서 약 30개의 분획을 수집하고 그 후 특성을 분석했습니다. 여기에서 0일째 Fruc-Hb 및 이로부터 파생된 분획은 10일째 Fruc-Hb 샘플 및 각각의 분획에 대한 대조군 역할을 했습니다.
GNP 합성에 사용된 모든 유리 제품은 Aqua Regia(HCl:HNO3 (주의! Aqua Regia는 부식성이 강한 산화제이므로 매우 조심스럽게 다루어야 합니다. ). GNP의 합성은 Hb의 당화 생성물의 환원 특성을 이용하여 수행되었다. 실온(RT)에서 수행된 일반적인 실험에서 32 μL의 HAuCl4 수용액 (1% w /v )을 일정한 교반 하에 3.868mL의 MilliQ 물에 첨가하였다. 금염이 완전히 용해되면 용액은 담황색으로 변합니다. 다음으로, 필수 Fruc-Hb 샘플 50μL 또는 분획 100μL를 금염 용액에 첨가했습니다. 모든 반응물이 완전히 혼합되면 교반을 중단하고 반응 혼합물을 방해하지 않고 GNP가 성장하도록 하였다. 최종 반응 혼합물에서 Fruc-Hb 샘플의 농도는 12.5ng μL -1 였습니다. (12.5μg mL −1 ) 분획의 분획은 1ng μL −1 (1 μg mL −1 ) (자세한 계산은 S6에 나와 있습니다). 첨가된 샘플에 따라 반응 혼합물에서 분홍색에서 보라색에 이르는 색상이 나타납니다. 모든 샘플은 반응 혼합물의 색상이 안정화되고 더 이상의 변화가 관찰되지 않을 때까지 유지되었습니다.
Fruc-Hb 샘플에서 수집된 분획은 Bradford 분석을 사용하여 단백질의 존재 또는 부재에 대해 분석되었습니다. 간단히 말해서, 20 μL의 원액 분획 각각에 약 200 μL의 Bradford 시약을 첨가하고 595 nm와 450 nm에서 흡광도를 측정하였다[58]. 595 nm에서 450 nm까지의 OD 비율은 분수 번호에 대해 표시되며 비율이 높을수록 단백질의 비율이 상대적으로 더 높음을 나타냅니다.
모든 Fruc-Hb 샘플의 UV-가시광 스펙트럼, 각각의 대조군 및 당화된 샘플의 크로마토그래피 분획을 Perkin Elmer, Lambda 25 UV-Visible 분광계로 기록했습니다. 240 nm/min의 스캔 속도 및 1 nm의 슬릿 폭으로 800에서 200 nm까지 스캔을 실행하여 스펙트럼을 얻었습니다. 모든 측정은 1cm 경로 길이, 1mL Quartz 큐벳을 사용하여 수행되었습니다. GNP의 UV-Visible 스펙트럼도 유사한 방식으로 기록되었습니다.
단백질 구조 변경 및 AGE 형성을 확인하기 위해 Agilent Technologies Cary Eclipse 형광 분광 광도계를 사용하여 Fruc-Hb 샘플의 형광 방출 프로파일과 Fruc-Hb 0일째 및 Fruc-Hb 10일째의 분획을 수행했습니다. 여기 및 방출 슬릿 폭은 5 nm로 설정하고 스펙트럼은 1 cm 경로 길이의 석영 큐벳을 사용하여 취했습니다. 샘플은 각각 트립토판 형광/고유 단백질 형광 및 AGE 형광을 확인하기 위해 280 nm 및 350 nm에서 여기되었습니다[34,35,36,37,38].
Fruc-Hb 샘플의 2차 구조 변경은 원형 이색성 분광법을 사용하여 확인되었습니다. 측정은 Stop Flow, Applied PhotoPhysics Chirascan(Applied Photophysics Limited, UK)이 있는 원형 이색성(CD) 분광기를 사용하여 수행되었습니다. 스펙트럼은 190~260nm 범위의 원자외선에서 촬영되었습니다.
모든 분광법 측정에서 Fruc-Hb 샘플은 0.1 mg mL −1 농도를 사용하고 0일 Fruc-Hb 및 10일 Fruc-Hb의 분획을 희석 없이 분석했습니다. 인산칼륨 완충액(pH 7.4, 10mM)은 모든 실험에서 공백으로 사용되었습니다. 모든 판독값은 실온에서 세 번 측정되었습니다.
Fruc-Hb 샘플과 각각의 대조군에서 합성된 GNP의 크기와 구조를 확인하기 위해 투과전자현미경(TEM)-JEOL 2100F를 사용하여 전자현미경 분석을 수행했습니다. GNP를 6000rpm에서 원심분리하여 농축하고 메쉬 크기 300의 구리 코팅된 탄소 그리드에 드롭 캐스팅했습니다. 샘플은 분석 전에 실온에서 밤새 건조되도록 둡니다.
GNP의 색상을 측정 가능한 값으로 표현하기 위해 디지털 색상을 사용하여 각 금 콜로이드에서 빨간색, 파란색 및 녹색 색상 평면을 추출하여 (RB)/G((Red intensity-Blue Intensity)/Green intensity)를 계산했습니다. 미터.
Sodium dodecyl sulphate-polyacrylamide gel electrophoresis(SDS PAGE)를 수행하여 당화 후 HbA0의 분자량 차이를 확인하였다. 0일, 10일의 HbA0 대조군 및 0일 및 10일의 Fruc-Hb를 6X 로딩 완충액을 함유하는 10% SDS와 혼합하고 5분 동안 끓인 후 30 μL의 샘플을 캐스팅된 겔(스택킹 겔- 5%, 분해 젤 - 12%). 샘플은 Bio-Rad의 Mini PROTEAN Tetrad 시스템을 사용하여 100V에서 10-175kDa PiNK Plus 사전 염색된 단백질 사다리(Cat No. PM005 0500)와 함께 실행되었습니다. 겔은 Bio-Rad Trans 조명기의 백색 광원 아래에서 시각화되었습니다.
<섹션 데이터-제목="결과">환원당 포도당은 생체 내에서 HbA0와 반응하여 당뇨병과 관련된 고혈당 수준의 주요 바이오마커인 잘 알려진 초기 당화 부가물인 HbA1c를 생성하는 것으로 알려져 있습니다[59]. 시험관 내에서 더 빠른 당화 반응 속도와 높은 AGE 축적을 달성하기 위해 후자와 비교하여 강력한 당화제인 포도당 대신 과당이 사용됩니다[55,56,57,58,59,60]. 우리 연구에서 우리는 환원당으로 과당을 사용하여 헤모글로빈 A0의 당화를 수행했으며 당화는 실질적인 AGE 형성에 충분하다고 보고된 10일까지 모니터링되었습니다[57]. 그림 1은 시험관 내에서 과당과 함께 10일 동안 배양한 후 HbA0 샘플에서 AGE의 형성을 보여줍니다. AGE 형성은 350 nm에서 여기 시 450 nm에서 형광 방출을 정성적으로 측정하여 평가되었습니다[38,39,40,41,42]. 450 nm에서 형광 방출의 10배 이상 증가는 글리코실화되지 않은 HbA0(0일 Fruc-Hb - HbA0와 과당의 물리적 혼합물)와 비교하여 글리코실화된 HbA0(10일 Fruc-Hb)에서 AGE 생성물의 형성을 확인했습니다. 샘플의 자세한 생물물리학적 특성은 추가 파일 1(S1 및 S2)에서 설명합니다.
<그림>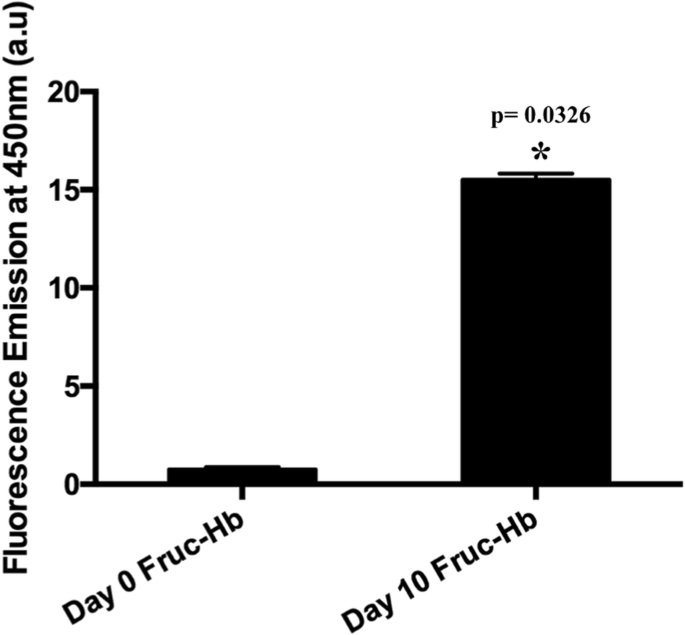
헤모글로빈을 과당과 함께 10일 동안 배양할 때 450 nm에서 형광 발생으로 측정한 AGE의 형성. 0일 Fruc-Hb와 10일 Fruc-Hb의 450nm 형광 방출 비교
GNP를 단백질 당화에서 파생된 AGE에 대한 비색 센서로 사용하기 위해서는 당과 단백질 반응물로부터 GNP의 형성 동역학을 연구하는 것이 전제 조건이었습니다. 과당과 헤모글로빈 A0는 단독으로 또는 강력한 환원제와 함께 사용될 때 금 나노구조의 합성을 지시하는 것으로 이미 보고되었습니다[53, 61,62,63]. 그러나 형성 역학의 차이를 이해하기 위해 추가 환원제 없이 각각 0일 및 10일 동안 배양된 Fruc-Hb, 과당 및 HbA0에서 합성된 GNP를 비교했습니다. 이러한 템플릿의 환원 특성은 방법 섹션에 설명된 프로토콜에 따라 생화학적으로 측정되었습니다. 전반적으로 10일째 샘플이 0일째 샘플보다 더 높은 환원성을 보였고 Fruc-Hb가 최대 환원성을 나타내었고 두 경우 모두 fructose와 HbA0가 뒤를 이었습니다. 이는 Fruc-Hb 샘플에 AGEs가 존재하기 때문일 수 있습니다 그림 2a). 이들 샘플 중 전형적인 농도에서 10일째 Fruc-Hb만이 4일이 끝날 때까지 안정적인 GNP의 합성에 기여한 반면(그림 2b), 나머지 샘플은 허용되었을 때만 그렇게 할 수 있었습니다. 장기간(일반적으로 10일 이상) 보관하고 결과는 얻은 샘플의 환원 특성과 일치합니다(데이터는 표시되지 않음). 10일째 Fruc-Hb_GNP의 가시광선 흡수 스펙트럼은 530nm 부근에서 피크를 생성했으며(그림 2c) 입자는 크기와 형태를 연구하기 위해 투과 전자 현미경(TEM)으로 특성화되었습니다(그림 2d). 전자 현미경 사진은 평균 직경이 21.930 ± 2.4 nm인 구형 입자의 존재를 보여주었습니다(그림 2e). 또한, 입자는 fcc 격자의 111, 200, 220, 311 평면에 해당하는 격자점을 갖는 본질적으로 다결정질이었습니다(그림 2f). 차별적으로 당화된 샘플에서 GNP 형성에 대한 자세한 동역학 분석은 S3에 나와 있습니다.
<그림>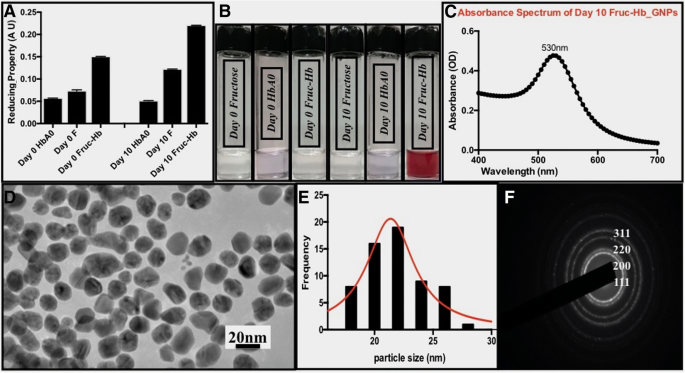
HbA0, 과당 및 Fruc-Hb 샘플에서 AGE 형성 및 GNP 합성의 특성화. 아 HbA0, fructose, Fruc-Hb의 0일과 10일 배양 시 각각 철 이온 환원 시험으로 측정한 환원 특성. ㄴ 각 샘플에서 합성한 GNP 사진. ㄷ 10일 Fruc-Hb_GNPs에 대한 UV-가시광선 흡수 스펙트럼. d 10일 Fruc-Hb_GNPs의 투과 전자 현미경 사진(스케일 바:20nm). 이 입자의 크기 분포 및 f 입자에 대한 SAED
여기에서 Fruc-Hb는 구형의 금 나노구조체 합성을 지시하는 안정제이자 주형으로 작용한다. 10일째 Fruc-Hb는 설탕 및 단백질 대응물에 비해 규정된 시간에 입자 합성을 가능하게 하기 때문에 이 메커니즘을 사용하여 당화 및 비당화 단백질 주형을 구별할 수 있습니다.
AGE 또는 단백질 백본의 변경이 10일째 Fruc-Hb 템플릿에 접종된 GNP에서 관찰된 차등 SPR 반응에 책임이 있는지 확인하는 것은 흥미로웠습니다. 추가 조사를 위해 방법 섹션에 설명된 대로 겔 여과 크로마토그래피를 사용하여 10일째 Fruc-Hb 및 0일째 Fruc-Hb를 분별했습니다. 0일 Fruc-Hb에서 파생된 분수는 10일 Fruc-Hb의 분수에 대한 대조군 역할을 했습니다. 그림 3은 분수의 분광학적 특성을 요약한 것입니다. 그림 3a는 0일 Fruc-Hb(빨간색) 및 10일 Fruc-Hb(검정색)에서 수집된 분획의 용출 프로파일을 보여줍니다. Fruc-Hb의 분류에 대해 얻은 특징적인 용출 프로파일은 이전 보고서와 일치합니다[37].
<사진>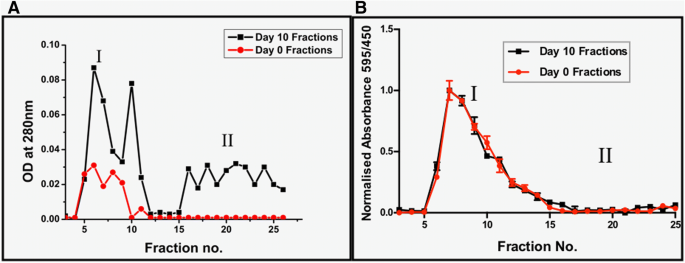
0일째 Fruc-Hb(빨간색) 및 10일째 Fruc-Hb(검정색) 분획의 용출 프로필. 280nm에서 측정된 UV 흡광도 프로파일(a ) 및 단백질 존재에 대한 Bradford 분석(b ) 0일 Fruc-Hb 및 10일 Fruc-Hb의 분수
0일과 10일의 분획에서 단백질의 존재는 단백질에 존재하는 방향족 아미노산에 의한 280 nm의 UV 광 흡수에 의해 확인되었습니다. 280 nm에서 광 흡수로 측정한 10일째 Fruc-Hb의 용출 프로파일은 I 및 II로 표시된 두 가지 제품 집단의 존재를 보여줍니다. 고분자량 제품으로 구성된 모집단 I은 분수 번호 5 ~ 12 및 분수 번호. 저분자량 제품에 해당하는 15개 이상은 모집단 II에 속합니다. UV 흡수가 관찰되지 않는 I와 II 사이에서 2-3개의 분획에 걸친 작은 범위가 관찰되었습니다. 한편, 0일째 Fruc-Hb의 단일 집단은 UV 광 흡수(집단 I)를 보여 10일째 분획의 II 영역에서의 흡수가 10일 Fruc-Hb에서 생성된 생성물에 의한 것임을 확인시켜줍니다. 당화. Maillard 반응의 중간체는 관찰을 뒷받침하는 근자외선 범위[64]에서 빛을 흡수한다고 이미 보고되었습니다. 0일 분획과 비교하여 10일 분획에 의해 280nm에서 UV 광 흡수가 향상되는 것은 당화의 결과로 단백질이 광범위하게 펼쳐져 방향족 아미노산이 노출되기 때문일 수 있습니다(그림 3a).
당화는 S1에서 논의된 바와 같이 단백질의 2차 및 4차 구조를 상당히 변경합니다. 분획 내 단백질의 구조적 상태를 확인하기 위해 분획의 SDS 폴리아크릴아미드 겔 전기영동을 수행한 결과, 단량체 및 이량체 밴드 대신 융합 밴드가 관찰되어 10일째 Fruc-Hb 샘플에서 단백질의 가교를 확인하는 융합 밴드가 관찰됨을 발견했습니다. (추가 파일 1:그림 S4).
0일째 Fruc-Hb와 10일째 Fruc-Hb의 용출 프로파일을 비교할 때, 집단 I에 속하는 분획은 본질적으로 단백질성이며 0일째 분획(비당화)에 완전히 부재한 두 번째 집단은 다음으로 구성됨을 식별합니다. 비단백질성 당화 생성물. 이러한 발견은 0일 및 10일 Fruc-Hb의 모집단 I에서 분획의 단백질 성질이 확인된 Bradford의 분석에 의한 단백질 추정에 의해 뒷받침됩니다(그림 3b). 간단히 말해서, 겔 여과 크로마토그래피에 의한 10일째 Fruc-Hb의 분획은 280 nm에서 빛을 흡수하는 두 가지 다른 집단의 분획을 산출했으며, 하나는 본질적으로 단백질성이고 다른 하나는 비-단백질성입니다.
자연에서 단백질성 및 비단백질성 당화 생성물의 용출을 이해하고, 이들 분획의 형광 방출을 450 nm에서 측정하여 AGE 생성물의 존재를 특성화하였다. UV 용출 프로파일과 유사하게, 10일째 분획에 대해 2개의 형광 방출 집단이 관찰되지만, 0일째 Fruc-Hb에 AGE 형성이 발생하지 않았기 때문에 0일째 분획 중 어느 것도 450 nm에서 형광 방출을 나타내지 않았습니다(그림 4). 형광의 강도는 당화 생성물의 차등 화학적 성질을 나타내는 10일째 분획 사이에서 상당히 다양했습니다. 형광 용출 프로파일에서 모집단 I에 속하는 초기 용출은 형광 강도가 높은 당화 생성물로 구성되었습니다. 이것은 도 3에 도시된 단백질 추정과 함께 이들 분획에서 단백질 구조로 구성된 형광성이 높은 당화 생성물의 용리를 시사한다. 두 번째 집단은 초기 분획에 비해 더 낮은 강도의 형광 방출을 나타냈다. 그들은 본질적으로 단백질이 아닌 것으로 밝혀졌지만(그림 3b) 280nm에서 UV 광을 흡수할 수 있습니다(그림 3a).
<그림>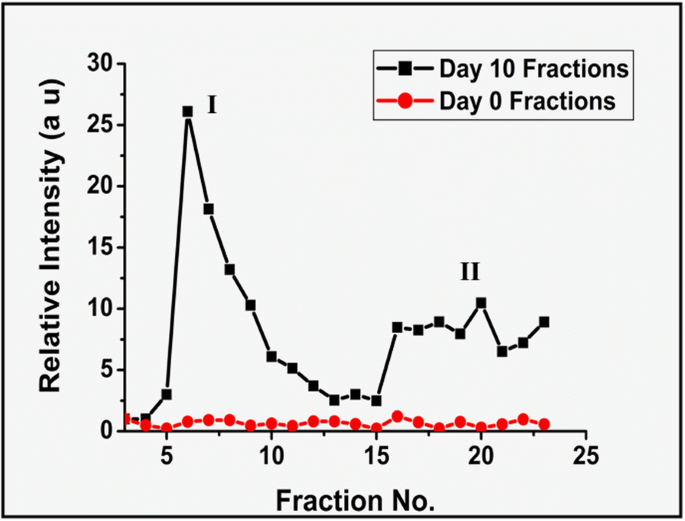
450 nm에서 형광 방출의 강도로 표현된 0일 Fruc-Hb 및 10일 Fruc-Hb 분획의 AGE 형광 비교
UV 흡수(그림 3)와 10일째 분획(그림 4)의 형광 방출을 고려하면 분획이 HbA0의 두 가지 다른 종류의 당화 생성물을 구별한다는 것이 분명합니다. 초기에 G25 컬럼에서 용출되는 분획의 집단은 고분자량이고 본질적으로 단백질이며 450 nm에서 강한 형광을 방출합니다. 두 번째 부류의 제품은 저분자량 비단백질성 구조로 450nm에서 형광을 방출하지만 강도는 비교적 낮습니다. 두 생성물 모두 'AGE' 형광을 나타내기 때문에 단백질 구조는 Maillard 반응 동안 초기에 형성되는 단백질 백본에 교차 연결된 AGE 생성물일 수 있고 두 번째 집단의 분획은 결과적으로 형성되는 당화 후기 생성물일 수 있습니다. AGE-단백질 가교의 분해.
GNP의 합성은 당화된 주형과 당화되지 않은 주형을 구별하는 데 사용할 수 있음이 분명합니다(그림 2). 이제 GNP가 10일째 Fruc-Hb의 단백질 및 비단백질 용리액을 구별할 수 있는지 조사하기 위해 방법에 설명된 대로 10일 Fruc-Hb에서 얻은 분획을 사용하여 GNP를 합성했습니다. 모든 샘플이 안정될 때까지 형성된 GNP의 색상을 모니터링했습니다.
그림 5에서 볼 수 있듯이 단백질 구조로 구성된 분획(집단 I) 중 어느 것도 눈에 띄는 GNP 형성을 나타내지 않은 반면, 비단백질성 AGE 생성물을 포함하는 분획(집단 II)은 콜로이드 용액에서 다양한 색상을 나타내는 안정적인 GNP를 생성했습니다. GNP의 형성은 UV-Visible 분광법을 사용하여 특성화되었으며 흡광도 최대값은 분수 번호에 대해 표시되었습니다. 분광학 데이터는 시각화된 GNP 색상 프로필을 잘 지원합니다. 이 데이터는 GNP 기반 감지 메커니즘에 기반한 당화 단백질 주형과 비당화 단백질 주형의 구별이 저분자량 AGE 제품에 의해 매개되며 동일한 메커니즘을 사용하여 단백질성 및 저분자량 비당화 단백질을 구별할 수 있다고 결론지었습니다. -단백질 당화 산물.
<그림>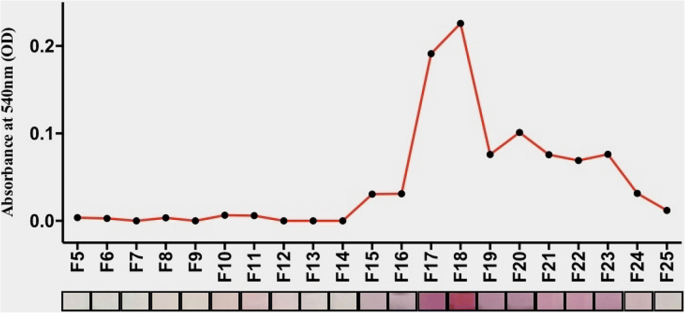
10일째 Fruc-Hb 분획으로부터의 GNP 합성. 10일차 분획에서 합성된 GNP의 비색 프로파일 및 분획 번호에 대해 플롯된 최대 흡수율
GNP 기반 비색 감지의 역학은 단순히 Fruc-Hb 및 금염의 농도를 증가시켜 응답 시간을 줄임으로써 더 크게 확장할 수 있습니다. When the concentrations of the Fruc-Hb and gold salt was increased four times than the concentrations used initially in this study, GNP formation was completed within 1 day, substantiating the use of the proposed colorimetric sensor for point-of-care applications (Additional file 1:Figure S5).
The linearity of detection for this colorimetric sensor was also confirmed using different concentrations of the day 10 glycosylated HbA0 (day 10 Fruc-Hb) (Fig. 6). Colour formation was not prominent enough for the lower concentrations of day 10 Fruc-Hb used, and as the concentration was increased from 20 to 40 ng/μL, the colour intensity increased linearly. This confirms that the colour intensity profile extracted from the GNPs obtained from differentially glycated haemoglobin samples can be used for qualitative measurement of AGEs in respective samples.
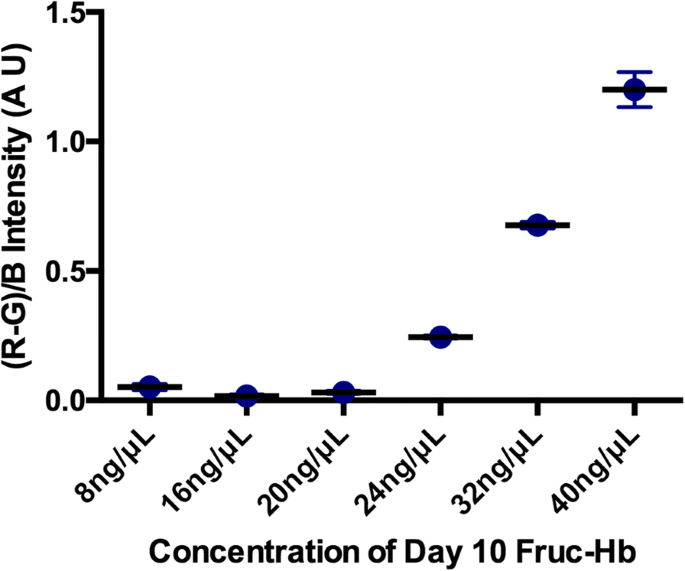
Linearity of detection. The red colour intensity as quantified by (R-G)/B intensity of GNP colloids plotted against the concentration of day 10 Fruc-Hb used for the synthesis. The concentration was varied from 8 to 40 ng/μL
The study presented here provides a detailed mechanism of GNP formation from a glycosylated HbA0 template and also discusses how this technique can be expanded for highly sensitive detection of AGE products in a simple manner. Our primary objective for this work was to establish a colorimetric sensing mechanism based on GNPs for the differentiation of glycated and non-glycated samples. The glycated HbA0 was found to be having high reducing property in comparison to the protein and sugar counterparts, enabling formation of stable and mono dispersed GNPs (Fig. 2). Since, among the control samples tested for GNP synthesis, only day 10 Fruc-Hb showed AGE fluorescence, the reactivity can be attributed to the AGE products than a mere structural alterations of the due to glycation (Figs. 1 and 2). To confirm this norm further, the products of glycation obtained from day 10 Fruc-Hb was fractionated to separate the products according to their molecular weights.
Fractionation of glycated Hb segregated two major population of products, high molecular weight proteinaceous (population I) and low molecular weight non-proteinaceous (population II) glycation products (Figs. 3 and 4). When GNPs were synthesised using these fractions of day 10 Fruc-Hb, it was found that only the products belonging to population II, the non-proteinaceous glycation products, were capable of carrying out the synthesis of particles (Fig. 5). This confirmed that the non-proteinaceous AGE products can initiate GNP synthesis by their own and the formation of GNPs from a Fruc-Hb template can be clearly attributed to the AGEs. Also, this opens up the possibility of using this property for the colorimetric detection of AGE products along with the distinction between proteinaceous and non-proteinaceous glycation products of HbA0.
Generally, CARBONYL groups present in the protein and sugar enable the stable synthesis of gold nanostructures in biological syntheses. Here, the generation of AGE products consisting of dicarbonyl functional groups during glycation might be providing the reducing environment for the proposed GNP synthesis [65]. As a matter of fact, the suggested mechanism can be used for the detection of advanced lipid per-oxidation end products (ALEs) as well, since the latter is also characterised by dicarbonyl functional groups and shares structural similarities with AGEs [66]. In short, GNPs synthesised from fractionated glycosylated Hb samples can clearly distinguish between proteinaceous and non-proteinaceous products. Our GNP-based simple colorimetric sensing of glycation products is highly sensitive and can detect nanogram levels of glycation products (S6) in a concentration-dependent manner (Fig. 6). The detection limit using the proposed sensing mechanism for the fractions is 1 ng/μL. The method developed in here can be scaled down to smaller reaction volumes without affecting the reaction kinetics, thus enabling lower sample requirements (data not shown) as well as enhance the reaction kinetics by increasing the concentrations (S5).
Concisely, in this study, we have demonstrated a colorimetric sensing mechanism for the non-proteinaceous AGE products which is simple and highly sensitive with a detection limit down to nanogram levels. Conditions like type 2 diabetes requires continuous monitoring of sugar levels at regular time intervals. Currently, levels of HbA1c formed as a result of extensive glycation of haemoglobin is used as a diagnostic means for diabetes. Chromatographic [67], electrophoretic and advanced technologies including high-performance liquid chromatography (HPLC) and mass spectrometry (MS) [12, 46,47,48,49, 68] are used for HbA1c detection. Early glycation adducts including fructosamines are also indicative of the glycemic control [69] which can be used as a marker for diabetes detection. Monitoring the AGE levels in addition to the HbA1c levels can significantly improve the determination the degree of complexity associated with diabetes, since the advancement of the disease is often associated with AGE formation and is involved in the progression of the disorder as well. Till date, the LC-MS/MS offers the highest selectivity and sensitivity in AGE detection [70]. But when it comes to simple, cost-effective, point-of-care diagnostics, our method can detect few nanograms of the sample compared to other fluorescence emission-based techniques [71, 72]. The method is highly specific for the AGEs, such that sugars and proteins do not develop any colour as such which are the expected interferences in the clinical samples such as blood or serum for the proposed study (Additional file 1 section 7). In this study, we have also segregated the products of glycation to proteinaceous and non-proteinaceous components and proved that non-proteinaceous AGEs are more reactive by the GNP based colorimetric assay. Further research can explore how this idea can be expanded for the distinction between different AGEs and thereby apply it for the diagnosis of organ specific diabetes-related complications.
Advanced glycation end products
Glycated Hb
금 나노 입자
Haemoglobin A0
표면 플라즈몬 공명
나노물질
구성품 및 소모품 Arduino MKR1000 × 1 맥박 센서 × 1 이 프로젝트 정보 사람의 활력징후는 오늘날의 의학에서 매우 중요합니다. 또한 오늘날에는 생체 신호를 장기간 측정하기 위해 웨어러블 전자 기기를 만드는 것이 필수적입니다. 따라서 환자의 맥박을 측정하려면 먼저 맥박 센서가 필요합니다. 심박변이도(HRV)는 심장 박동 사이의 시간 간격이 변하는 생리적 현상입니다. 심박수는 시시각각 변하며 국부적인 감정적 각성과 광범위한 생리적 활동을 집계하는 풍부한 신호를
폴리머가 사용되는 업계에는 수많은 제품과 하위 어셈블리가 있습니다. 특성, 성능 및 수명은 합성되는 이러한 재료의 구성과 구조에 중요한 역할을 합니다. 수명은 제한되어 있으며 환경, 사용되는 첨가제, 안정제 및 폴리머의 사용 범위를 포함한 다양한 요인에 따라 달라집니다. Agilent GPC/SEC 시스템은 생분해성 폴리머의 분자량 분포를 연구하는 신뢰할 수 있는 방법입니다.견적 요청 Agilent는 정확성과 신뢰성을 원하는 조직에 탁월한 선택이 될 수 있습니다. 플라스틱 플라스틱의 품질과 화학적 조성을 측정하는 공정은 의심할