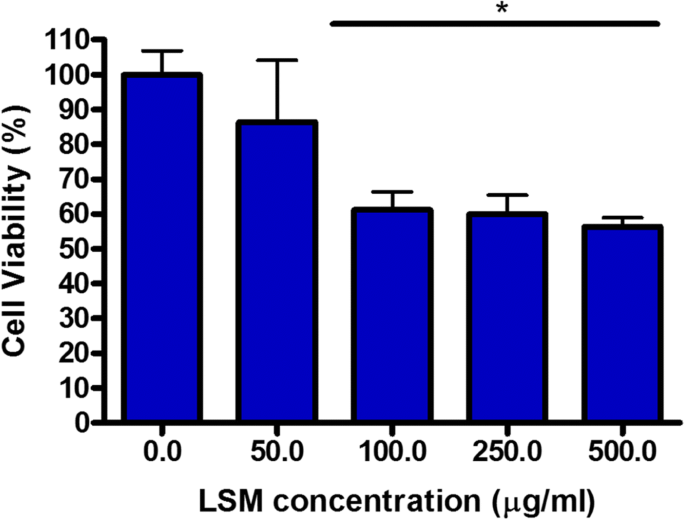
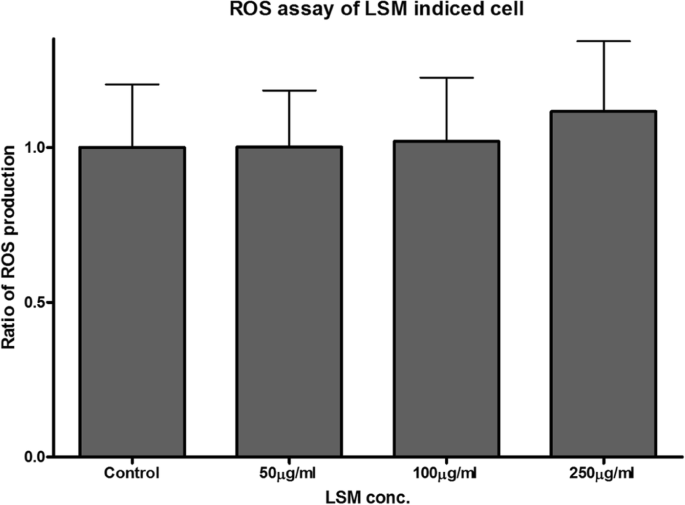
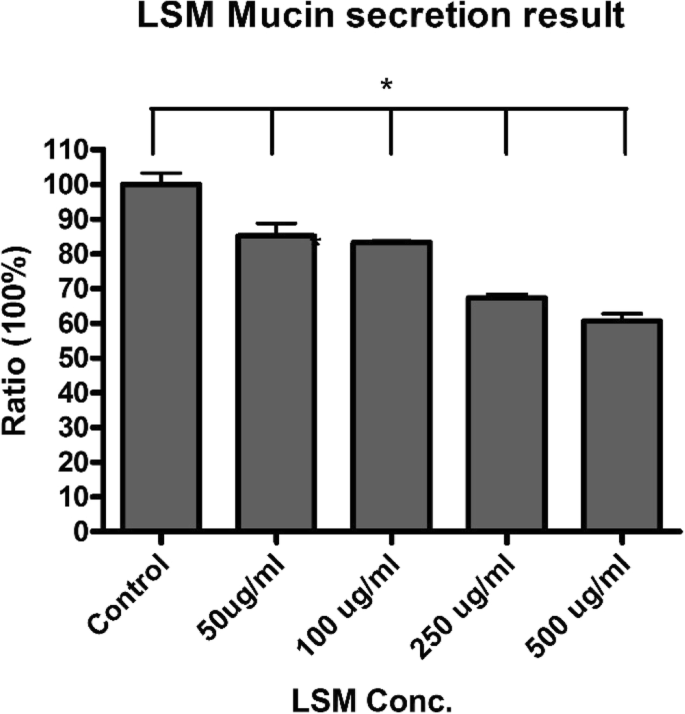
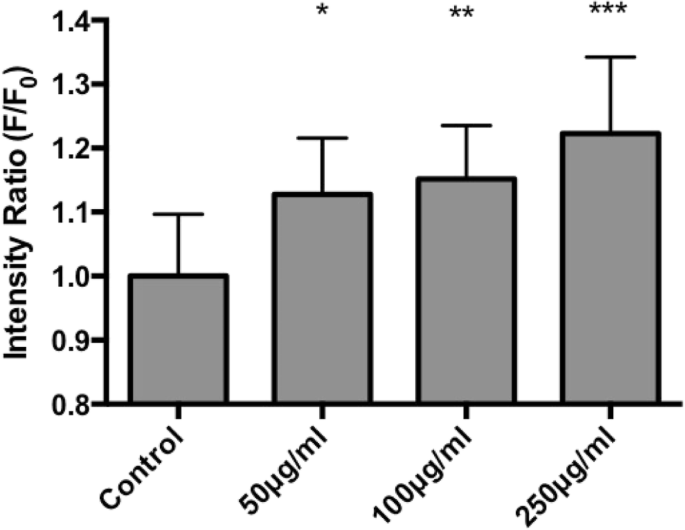
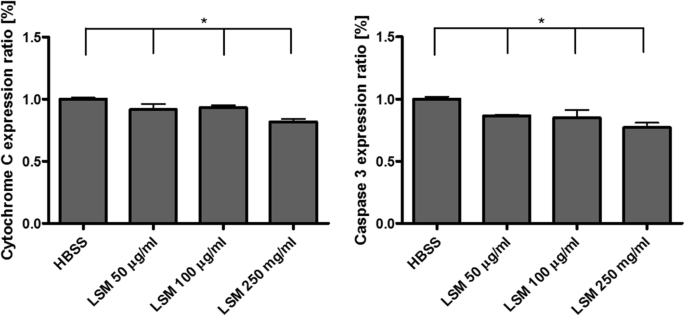
최근 나노독성 연구는 산업 및 상업 제품에서 광범위하게 사용되는 나노입자의 독성 효과에 대해 많은 관심을 끌고 있습니다. 나노독성의 주요 관심사는 ROS의 생성 때문입니다. 예:TiO2 나노입자는 많은 양의 생성된 ROS로 인해 세포 사멸 및 돌연변이를 유발할 수 있기 때문에 일종의 발암 물질로 간주되고 있습니다[28]. 최근 몇 년 동안 다양한 응용 분야에서 보고된 페로브스카이트로 분류되는 다양한 유형의 재료 및 화합물이 있습니다. 이것은 세포가 NP를 흡수하는 주요 경로 중 하나인 기도 상피 세포에 대한 LSM 독성을 결정하기 위한 첫 번째 연구입니다. 이 연구는 독성을 평가하기 위한 노력의 일환으로 LSM이 기관 세포에 미치는 영향을 조사하는 것을 목표로 했습니다. 결과는 LSM이 사이토크롬 C 및 카스파제 3 발현으로 측정한 세포자멸사 진행, JC-1 형광으로 측정한 미토콘드리아 완전성, 세포 생존 및 ROS 생산에 유의미한 영향을 미치지 않는 것으로 나타났습니다. 그러나 처리는 점액 분비에 대한 억제 효과를 보여 LSM 농도가 증가함에 따라 점액 생성을 감소시켰다. 궁극적으로, 이 연구에서 얻은 결과를 통해 LSM은 기도 상피 세포에 대해 무독성인 것으로 밝혀졌고 세포자멸 단계에 큰 변화를 일으키지 않고 추가로 세포 생존을 위태롭게 할 수 있는 점액 분비를 낮추는 것으로 나타났습니다. 이는 LSM이 기도 점액 제거를 방해할 가능성이 있음을 시사합니다. 우리 연구에서 우리는 LSM NP에 대한 독성 가능성을 입증했으며 결과는 독성 효과의 잠재적 위험이 산업 및 상업용으로 사용되었던 다른 NP보다 상대적으로 낮다는 것을 보여줍니다. 그러나 LSM이 상업용 태양열 및 에너지 저장 제품의 활성 성분으로 안전하게 통합될 수 있는지 여부를 결정하기 위해 추가 연구가 수행되어야 합니다.
자료 및 방법
기관 1차 세포의 배양
기관 1차 상피 세포는 이전에 공개된 프로토콜에 따라 정상 소 기관지 상피로부터 분리되었습니다[26]. 세포는 사전 검증된 인간 재조합 표피 성장 인자 1-53(EGF 1-53) 및 소 뇌하수체 추출물(BPE)(Thermo Fisher)이 공급된 무혈청 배지(SFM)에서 성장 및 유지되었습니다. 1차 기관 세포를 콜라겐() 사전 코팅된 15cm 팔콘 플레이트에서 배양하고 37°C, 5% CO2의 가습 배양기에서 배양했습니다. . 세포 계수는 트립판 블루(Sigma) 배제 및 브라이트 라인 혈구계를 사용하여 수행되었습니다. 합류가 80%에 도달했을 때 세포가 통과되었습니다.
셀 준비
세포를 5 × 10
4
으로 접종했습니다. 세포 생존 분석을 위한 콜라겐 코팅 96웰 플레이트(75% 합류)의 웰당 세포, 5 × 10
5
Ca
2+
용 콜라겐 코팅 4웰 플레이트(75% 합류)의 웰당 세포 신호, ROS 및 미토콘드리아 분석. 접종 후 세포는 사전 검증된 인간 재조합 EGF 1-53 및 BPE(Thermo Fisher)가 보충된 SFM에서 24시간 동안 배양되었습니다. 24시간의 배양 후, 배지를 세포에서 제거하고 배양물을 인산염 완충 식염수로 2회 헹구었습니다. PBS 세척은 Ca
2+
에서 초음파 처리된 나노 입자로 대체되었습니다. Hanks 또는 Ca
2 +
포함 -무료 행크스.
세포 생존 분석
세포독성의 광비색 측정은 CCK-8 염료(Dojindo Laboratories, Tokyo, Japan)를 사용하여 평가되었습니다[27, 25]. 비방사성인 CCK-8은 다양한 NP 농도에 노출된 생존 세포의 백분율에 대한 비색 측정을 제공합니다. 이 분석 키트는 WST-8 테트라졸륨염을 수용성 포르마잔으로 전환시키는 생존 세포 내 탈수소효소의 대사 활성을 측정합니다. 1:10 희석으로 HBSS에 CCK-8을 첨가하여 제조했습니다. 세포를 HBSS로 헹구고 100μL의 염료를 각 웰에 로딩했습니다. 그런 다음, 세포를 37°C, 5% CO2에서 배양했습니다. 6시간 동안 인큐베이터 흡광도는 450nm의 광학 밀도(650nm 기준)에서 Thermo Multiscan EX 플레이트 리더(Thermo Multiskan EX 플레이트 리더, VWR, CA, USA)를 사용하여 측정되었습니다. 3개의 독립적인 실험에서 처리되지 않은 대조군을 포함하여 각 농도에 대한 3개의 개별 데이터 세트에서 평균을 계산하고 처리되지 않은 대조군의 백분율로 표로 작성했습니다.
세포 생존율은 \( \frac{OD_{450\mathrm{치료}}-{OD}_{650\mathrm{치료}}}{O{D}_{450\mathrm{대조군}}-O에 의해 계산되었습니다. {D}_{650\mathrm{컨트롤}}}\ast 100\% \).
란타늄 스트론튬 망가나이트 나노입자
란탄 스트론튬 망가나이트(La0.15 Sr0.85 MnO3 )(LSM) 나노입자(35 nm, 99.5%)(Nanostructured&Amorphous Materials Inc.)가 이 연구에 사용되었습니다. 모든 NP 샘플은 사용 전에 초음파 처리되었습니다. 사용된 농도는 500μg/ml, 250μg/ml, 100μg/ml 및 50μg/ml입니다. 사용된 농도의 범위는 TiO2의 농도에 따라 결정되었습니다. 이전 보고서에서 발견된 NP(Dowding et al. 2014; Dowding et al. 2012; Gurr et al. 2005; Hirst et al. 2009; Niu et al. 2011). LSM NP는 개별적으로 테스트하기 전에 Hanks의 용액(Invitrogen, CA, USA)으로 재구성되었으며 사용 직전에 약 5분 동안 초음파 처리되었습니다.
주사형 전자 현미경
LSM NP를 5μg/ml로 제조하고 깨끗한 실리콘 웨이퍼에 드롭 캐스트하고 공기 건조하여 잔류 물을 제거했습니다. NP의 크기는 주사전자현미경(Gemini SEM, Zeiss)을 이용하여 독립적으로 확인하였다.
세포내 반응성 산소 종 생산
활성산소종(ROS) 생성은 CM-H2DCFDA 염료(Invitrogen, CA, USA)의 산화를 이용한 형광현미경으로 평가하였다[24]. 세포(1 × 105 cells/well)를 PBS 용액으로 헹구기 전에 24시간 동안 배양했습니다. 샘플은 배지에 2μM 재구성된 CM-H2DCFDA 염료를 포함하는 로딩 버퍼를 30분 동안 적용하여 염색했습니다. 염색된 샘플을 PBS로 3회 세척하고 세포 에스테라제가 AM 또는 아세테이트 그룹을 가수분해하고 염료가 산화에 반응하도록 하기 위해 5분의 회복 시간 동안 따로 보관했습니다. 그런 다음 50μg/ml에 0~500μg/ml 범위의 농도로 LSM NP를 포함하는 행크스 완충액을 37°C에서 15분 동안 세포와 함께 배양한 다음 PBS로 세척했습니다. 세포에서 생성된 ROS의 형광 이미지를 캡처하고 다른 처리군과 대조군 사이의 형광 강도 증가 비율을 계산하여 분석했습니다.
미토콘드리아 손상 측정
미토콘드리아 내부 막횡단 전위는 다색 5,5',6,6'-테트라클로로-1,1',3,3'-테트라에틸벤즈이미도아졸릴-카르보시아니오 요오다이드(JC-1 Sigma)를 사용하여 평가되었습니다[25]. JC-1은 미토콘드리아 막에 통합될 수 있는 친유성 형광 양이온으로 막 전위 상태 집합체에 의존합니다. 응집은 JC-1의 형광 특성을 변경하여 녹색에서 적색 형광으로 이동합니다. JC-1로 염색된 온전한 미토콘드리아 막은 형광 현미경으로 감지할 수 있는 뚜렷한 적색 미토콘드리아 형광을 나타냅니다. 미토콘드리아 막 전위의 붕괴는 녹색 형광의 후속 감소와 적색 형광의 증가를 초래합니다. NPs 자극 전에 세포를 PBS로 2회 세척하고 37°C 배지에서 JC-1 염색 시약(1:1000)과 함께 30분 동안 배양한 다음 PBS로 세척하고 세포 처리했습니다. 미토콘드리아 막 전위는 10분 간격으로 형광 현미경으로 검출되었습니다.
[Ca
2+
측정 ]c
모든 실험은 어두운 조건에서 수행되었습니다. 세포에 Rhod-2 AM 염료(1μM)(K d =570nM, λ예 =552nm 및 λEm =581nm)(Invitrogen, CA, USA) 45분 그런 다음 세포를 PBS로 두 번 세척한 다음 Hanks 완충액으로 배양하고 적절한 NP 농도로 처리했습니다. 모든 Ca
2+
신호 실험은 Nikon 현미경(Nikon Eclipse TE2000-U, Tokyo, Japan)에 장착된 37°C의 온도 조절 상태에서 수행되었습니다[24, 25, 27](Chen et al. 2011).
뮤신 분비 및 ELLA
세포를 1 × 10
6
으로 시딩했습니다. 6웰 플레이트에 웰당 세포를 넣고 24시간 동안 배양합니다. 그런 다음 기관 1차 세포를 PBS로 헹구고 PBS에 준비된 해당 LSM NP 농도(500μg/ml, 250μg/ml 및 100μg/ml)로 15분 동안 자극했습니다. 분비된 뮤신을 함유하는 상청액을 수집하고 8000rpm에서 잠시 원심분리하여 잔류 NP를 제거했습니다. 그런 다음 상층액을 4°C에서 밤새 96웰(Nunc MaxiSorp, VWR, CA, USA) 플레이트에서 인큐베이션했습니다. 이후 PBST(PBS + 0.05% Tween-20)로 96-well plate를 세척한 후 1% BSA로 차단하였다. 96웰 플레이트를 PBST로 다시 세척하고 렉틴(Wheat germ agglutinin, WGA)(Sigma-Aldrich, MO, USA)과 함께 인큐베이션하고 양고추냉이 퍼옥시다제(HRP; 5mg/ml)(Sigma-Aldrich, MO, 미국), 37°C에서 1시간 기질인 3,3',5,5'-테트라메틸벤지딘(TMB; Sigma-Aldrich, MO, USA)을 실온에서 각 웰에 첨가한 다음 H2 SO4 (Sigma-Aldrich, MO, USA) 반응을 종료하기 위해. 광학 밀도는 450nm에서 측정되었습니다(Chen et al. 2011; Kemp et al. 2004).
면역흡착 분석(ELISA) 준비
세포는 1 × 10
6
의 밀도로 시딩되었습니다. 6웰 플레이트에서 세포 밀도를 측정하고 24시간 동안 배양했습니다. 이어서 기관 세포를 PBS로 헹구었다. PBS에서 준비된 적절한 LSM NP 농도(0~500μg/ml)로 세포를 2시간 동안 자극했습니다. Peirce RIPA 세포 용해물 시약으로 세포 용해를 준비하고 용해물을 수집하여 미세 원심분리 튜브로 옮겼습니다. 샘플을 ~ 14,000×g에서 원심분리했습니다. 15분 동안 세포 파편과 NP를 펠렛화합니다. 그런 다음 상층액을 4°C에서 밤새 96웰 플레이트에서 인큐베이션했습니다. 이후 PBST(PBS + 0.05% Tween-20)로 96-well plate를 세척한 후 1% BSA로 차단하였다. 96웰 플레이트를 PBST로 다시 세척하고 토끼 항-카스파제 3, 활성 형태 항체(Millipore, 다클론 항체) 및 마우스 항-사이토크롬 C(Invitrogen, 단클론 항체)와 함께 실온에서 2시간 동안 인큐베이션했습니다. 그런 다음 2차 항체(anti-rabbit and anti-mouse conjugated horseradish peroxidase, HRP, Millipore)를 사용하고 ELLA와 동일한 절차를 거쳐 흡광도를 측정합니다[25].
이미지 분석
이미지 분석은 도립된 Nikon Eclipse TE2000-U 형광 현미경으로 수행되었습니다. 각 사진은 × 10 배율로 촬영되었고 Simple PCI(Compix Inc., Imaging Systems, Sewickle, PA, USA)를 사용하여 분석되었습니다. 세포질 칼슘 농도에 대해 표시된 데이터는 Rhod-2 형광으로 표시됩니다. 이미지는 0.5초마다 촬영되었으며 분석을 위해 자동으로 회색조로 변환되었습니다. 단순 PCI는 나노입자 자극 직후 100 s(~ 200프레임)에 걸쳐 200개 세포에 대해 프레임당 평균 형광을 갖는 선택된 영역의 픽셀 강도(평균 회색 값)를 제공했습니다. 면역형광 염색에 대해 표시된 데이터는 그래핀을 1~2시간 처리한 후의 단백질 발현을 나타냅니다. 모든 실험은 최소 3번 이상 독립적으로 수행되고 확인되었습니다.
통계 분석
데이터는 평균 ± SD로 표시되었습니다. 각 실험은 최소 3회 독립적으로 수행되었습니다. p를 사용하여 일원 분산 분석 테스트 분석을 사용하여 통계적 유의성을 결정했습니다. 값 <0.05(GraphPad Prism 4.0, GraphPad Software, Inc., San Diego, CA, USA).
약어
- BPE:
-
소 뇌하수체 추출물
- ELISA:
-
효소 결합 면역흡착 분석
- LSM:
-
란타늄 스트론튬 망가나이트
- ROS:
-
활성 산소 종
- SFM:
-
무혈청 배지
- SOFC:
-
태양광 산화 연료 전지