나노물질








리튬 기반 물질은 고용량과 안정적인 사이클 성능으로 인해 리튬 이온 배터리의 음이온(산소) 산화환원 반응을 기반으로 하는 유망한 양극입니다. 이 연구에서 Li2에 의해 활성화된 리튬 기반 음극의 특성 RuO3 특성화되었다. Ru계 산화물은 음이온 산화환원 반응을 안정화시키는 역할을 할 수 있어 좋은 촉매 역할을 할 것으로 기대된다. 그들의 높은 전자 전도성은 또한 리튬의 낮은 전도도를 보상할 수 있기 때문에 매력적입니다. 리시아/Li2 RuO3 나노복합체는 500mAh g −1 의 용량 한계까지 안정적인 순환 성능을 나타냅니다. 이론적인 용량(897 mAh g −1 미만)에 도달했습니다. ) 그러나 다른 리튬 기반 음극보다 우수합니다. XPS 분석에서 스펙트럼의 Ru 3d 피크는 거의 변하지 않았지만 퍼옥소 유사(O2 ) n− 종은 순환하는 동안 가역적으로 형성되고 해리됩니다. 이것은 lithia/Li2의 용량이 RuO3 나노복합체는 대부분 음이온성(산소) 산화환원 반응에 기인할 수 있습니다.
우리 사회는 휴대폰, 노트북, 전기자동차의 사용 증가로 인해 에너지 저장 시스템(ESS)에 대한 의존도가 높아지고 있습니다. 또한 친환경 발전 시스템에서 생산된 전기는 대형 ESS(Energy Storage System)에 저장해야 합니다. 이러한 ESS의 사례는 대부분 이차전지 시스템을 기반으로 하고 있으며, 이는 가장 앞선 이차전지로 간주되는 리튬이온전지(LIB)의 시장 점유율을 빠르게 성장시켰습니다. 그러나 현재 LIB의 에너지 밀도는 많은 응용 분야의 요구 사항을 충족하기에 충분하지 않습니다[1,2,3,4,5,6,7]. 따라서 많은 연구가 배터리 시스템의 에너지 밀도 향상에 중점을 두었습니다. 특히, 기존의 전이금속계 산화물보다 높은 가역용량을 나타내는 우수한 양극재 개발이 큰 관심을 받고 있다[1,2,3,4,5,6,7].
음이온(산소) 산화환원 반응과 호환되는 여러 재료는 에너지 밀도가 높은 음극에 대한 가능성을 보유할 수 있습니다[8,9,10,11,12,13,14,15,16]. 현재 사용되는 양극재의 가역방전용량은 화합물 내 양이온 전이금속 이온의 산화환원 반응을 기반으로 한다. 그러나 산소에 뿌리를 둔 음이온 산화환원 반응의 도입은 잠재적으로 높은 가역 용량을 유도하여 전이 금속 산화물의 용량 한계를 극복할 수 있습니다. 예를 들어, 산소 산화환원 반응(ORR)은 주로 x와 같은 리튬이 풍부한 물질의 높은 에너지 밀도를 담당합니다. 리2 MnO3 − (1 − x )Li(Ni,Mn)O2 [17, 18]. Li가 풍부한 물질이 양이온(전이금속 산화물) 산화환원 반응 영역에 충전되면 가역적 ORR(2O 2- ➔ O2 x - ) 진행합니다. 이 반응은 전이 금속 이온의 양이온 산화 환원 반응과 함께 Li가 풍부한 물질의 가역적 용량에 기여합니다. 그러나 이러한 반응은 ORR을 활성화하기 위해 높은 충전 전압(> 4.5 V)을 필요로 하며, 이는 유기 전해질의 분해를 유발하고 심각한 용량 감소를 유발합니다[19,20,21,22,23].
리티아(Li2 최근 ORR을 기반으로 한 양극재로 O)계 화합물이 제안되고 있다[24,25,26,27,28,29]. Li가 풍부한 화합물의 가역적 용량은 주로 전이 금속 이온의 양이온 산화환원 반응에 기인하는 반면, 리튬 기반 화합물의 가역 용량은 거의 전적으로 O 2-<사이의 음이온(산소) 산화환원 반응에 의존합니다. /sup> 및 O x - (0.5 ≤ x <2). 이 배터리 화학은 주로 ORR을 사용한다는 점에서 리튬 공기 배터리와 유사합니다. 그러나 Li-air 배터리의 기본적인 산화환원 반응은 기체(O2 ) 고체(Li2 O2 ); 이 반응은 조성 변화가 없는 "상전이"만이 아니라 리튬 이온을 포함하는 화학 반응입니다. 그러나 상변화를 동반하기 때문에 이 연구 분야에서는 "상전이" 과정이라고 한다. Li-공기 전지의 용량 감소 및 높은 과전위는 기체와 고체 사이의 접촉 불안정으로 인해 발생하여 느린 반응 속도를 초래합니다[30,31,32,33,34,35,36]. 이에 반해 리튬계 화합물의 산소 이온은 충방전 과정에서 상전이 없이 고체상을 유지한다. 따라서 리튬계 화합물은 Li-air 전극의 하위 분류라기 보다는 LIB의 새로운 양극 소재로 분류될 수 있습니다.
실제로 고체 리튬의 산소 이온은 충전 과정에서 거의 활성화되지 않습니다. 따라서 촉매(때때로 도펀트라고도 함)는 리튬에서 산소 이온을 활성화하고 반응 생성물(Li2 O2 또는 LiO2 ). Co, Fe 및 Cu 산화물은 리튬을 활성화하기 위한 촉매로 사용되어 왔으며[24,25,26,27,28,29], 리튬 기반 화합물의 전기화학적 성능은 존재하는 촉매의 조성 및 양에 매우 민감합니다. 보다 효율적인 촉매를 찾기 위한 노력의 일환으로 Li2 RuO3 이 연구에서 리튬의 활성화를 위한 새로운 촉매로 도입되었습니다. 우리는 Ru 이온이 Li가 풍부한 산화물에서 음이온 산화환원 반응을 안정화시키는 역할을 하고[37,38,39], Ru 기반의 Li가 풍부한 산화물이 더 가역적인 산소 산화환원 과정을 나타내고 산소 방출에 대해 구조적으로 더 안정하다는 점에 주목했습니다. Co, Ni 및 Mn 기반 Li가 풍부한 산화물과 비교됩니다. 이것은 Ru 이온이 이전에 사용된 다른 전이 금속 이온(예:Co, Fe 및 Cu)보다 ORR을 활성화하기 위해 더 안정적이고 더 나은 촉매가 될 가능성이 있음을 의미합니다. 또한, Ru 산화물의 높은 전자 전도도는 리튬의 불충분한 전도도를 보완할 수 있습니다. 이번 작업에서는 lithia/Li2를 준비했습니다. RuO3 촉매로서 Ru 산화물의 효과를 확인하기 위해 X선 회절법(XRD), X선 광전자 분광법(XPS) 및 전기화학적 측정을 사용하여 나노복합체의 특성을 조사했습니다. 반응식 1은 lithia/Li2의 구조를 보여줍니다. RuO3 이 연구에서 나노복합체 및 필수 개념.
<그림>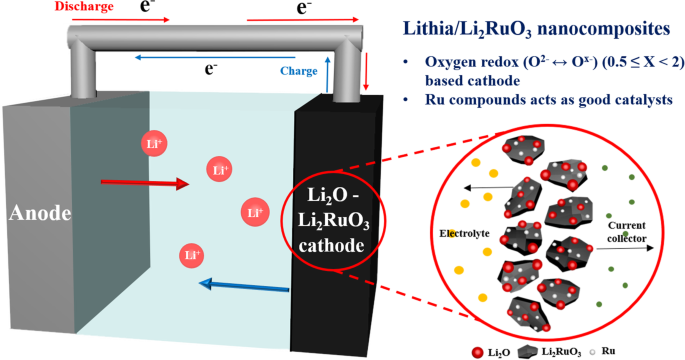
lithia/Li2의 구조를 보여주는 개략도 RuO3 이 연구에서 나노복합체 및 필수 개념.
리2 RuO3 나노리튬을 활성화하기 위한 촉매로 사용되었다. Li2를 형성하려면 RuO3 , RuO2 (Alfa Aesar, 99.9%) 및 Li2 CO3 (Aldrich, 99.99%)를 1:1(mol%) 비율로 펠릿화하고 공기 중에서 950°C에서 24시간 동안 소성했습니다. 그 후 소성된 펠릿을 분말로 분쇄하였다. 리2 RuO3 및 나노리튬(Li2 O) 분말(Alfa Aesar, 99.5%)을 결합하여 Ru 함량(f 루 =Ru/(Ru + Li)) 0.09, 그 다음 부탄올에 분산됨(Aldrich, 무수, 99.8%). 혼합물을 30분 동안 초음파 처리한 다음 여과하였다. 얻은 Li2 RuO3 /리2 O 분말을 90°C에서 24시간 동안 진공 건조한 다음 Planetary Mono Mill(PULVERISETTE 6, FRITSCH)을 사용하여 볼 밀링하여 리튬/Li2 RuO3 나노복합체. 밀링은 600 rpm에서 150 h(1시간 밀링 후 30 분 휴지) 동안 수행되었습니다. 5 mm 및 10 mm 직경의 지르코니아 볼을 1:1(wt%) 비율로 사용했습니다. 밀링 공정은 글로브 박스와 밀봉된 지르코니아 용기를 사용하여 Ar 분위기에서 수행하였다. 합성된 lithia/Li2의 XRD 패턴 RuO3 나노복합체 분말은 단색 Cu Kα로 10–90°의 2θ 범위에 걸쳐 Rigaku Miniflex II X선 회절계를 사용하여 얻어졌습니다. 방사선(λ =1.5406 Å). Li2의 분산 정도를 관찰하려면 RuO3 lithia/Li2의 lithia RuO3 나노복합체, 고해상도 투과전자현미경(HR-TEM; JEM-2100F) 및 에너지 분산 X선 분광법(EDS)이 사용되었습니다.
전기화학적 시험을 위해 활성물질(lithia/Li2 RuO3 나노복합체), 탄소나노튜브 및 폴리불화비닐리덴(PVDF) 바인더를 60:30:10(wt%)의 비율로 포함합니다. 참고로 Li2 RuO3 전극은 또한 80:12:8의 비율로 준비되었습니다(Li2의 중량% RuO3 /탄소 나노튜브/PVDF). 전극 부품의 볼 밀링은 90분 동안 수행되었습니다. 그 후, lithia/Li2 RuO3 나노복합체 및 Li2 RuO3 슬러리를 알루미늄 호일에 주조하고 24시간 동안 80°C에서 진공 건조했습니다.
코인 셀(2032형)은 양극으로 Li 금속, 1 M LiPF6를 사용하여 전기화학적 테스트에 사용되었습니다. 에틸렌 카보네이트와 디메틸 카보네이트(1:1 v/v)에서 전해질로 5 vol%의 비닐렌 카보네이트를 포함하고 분리막으로 폴리프로필렌(Celgard 2400)을 사용합니다. 세포는 Ar이 채워진 글로브 박스에 조립되었습니다. 리시아/Li2 RuO3 나노복합체 전지는 다양한 전류 밀도(10, 30, 100 및 200 mA g −1 )로 1.8–4.35 V의 전위 범위를 순환했습니다. ). 리튬의 질량을 기준으로 계산된 음극의 용량은 300–600mAh g −1 으로 제한되었습니다. . 리2 RuO3 셀은 또한 30 mA g −1 의 전류 밀도로 2.0–4.6 V의 전위 범위에서 순환했습니다. .
lithia/Li2의 구조적 특성 RuO3 나노복합체는 XRD 및 TEM을 사용하여 조사되었습니다. 그림 1은 lithia/Li2의 XRD 패턴을 보여줍니다. RuO3 나노복합체, Li2 RuO3 , 리2 O(리시아), Ru. lithia/Li2의 회절 패턴 RuO3 나노복합체는 원료(Li2 RuO3 및 lithia) 및 새로 형성된 Ru 피크. 날카롭고 큰 Ru 피크는 일부 Li2 RuO3 밀링 과정에서 Ru로 분해됩니다. 그러나 Li2에 대한 광범위하지만 큰 회절 피크 RuO3 상당한 양의 Li2 RuO3 대부분의 결정질 Li2 RuO3 밀링 과정을 거쳐 비정질 상으로 변한 것으로 보인다. 리튬 피크의 감소는 결정질 리튬도 비정질 상으로 변경됨을 보여줍니다. 비정질 상의 존재는 감소된 전기 전도도와 같은 부정적인 영향을 초래할 수 있습니다. 그러나 이것은 또한 비정질 리튬의 상전이가 충방전 과정에서 결정질 리튬보다 에너지를 덜 필요로 하기 때문에 과전위를 낮출 수 있습니다[29].
<그림>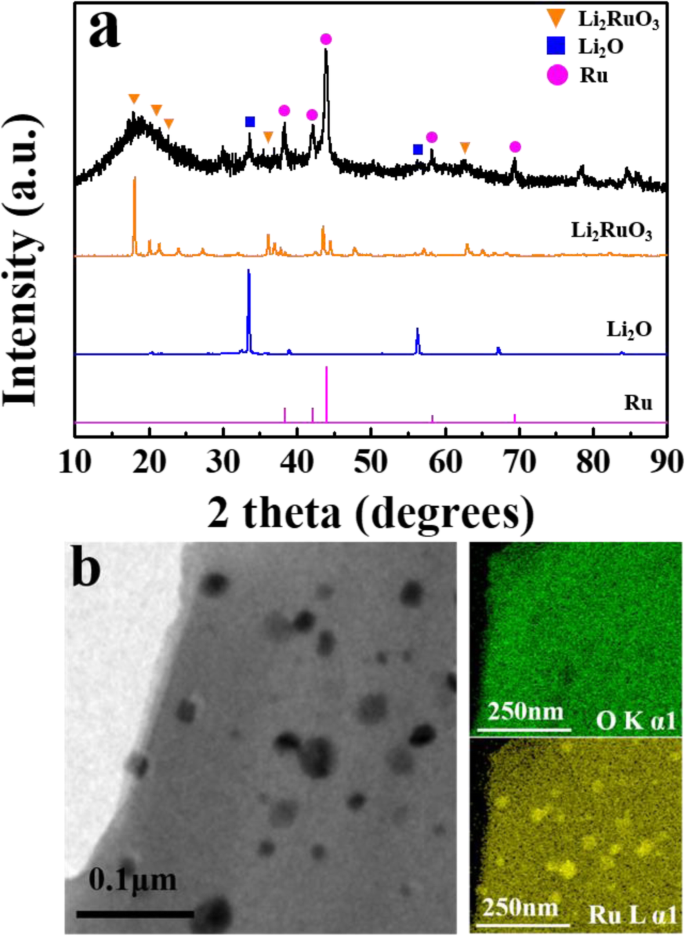
아 lithia/Li2의 XRD 패턴 RuO3 Li2와 비교한 나노복합체 RuO3 , 리2 오, 그리고 루. ㄴ lithia/Li2의 TEM 이미지 및 EDS 요소 매핑 RuO3 나노복합 분말
XRD 분석에 따르면 비정질 Li2 RuO3 또한 Ru는 리티아를 활성화하기 위한 촉매로 작용할 수 있습니다. 촉매의 분포와 나노복합체의 형태는 HR-TEM과 EDS 원소 매핑에 의해 관찰되었다. 도 1b에 도시된 바와 같이, 나노복합체의 HR-TEM 이미지는 이 섹션에서 다량의 Ru를 보여주는 EDS 매핑에 의해 뒷받침되는 Ru 입자일 가능성이 있는 여러 어두운 점을 포함한다. Ru가 Li2의 분해에 의해 형성되면 RuO3 , 금속 Ru의 연성으로 인해 밀링 공정에서 미세하게 분산되기 어려운 것으로 보입니다. 따라서 Ru 입자 중 일부는 덩어리로 보입니다. 나머지 나노복합체 물질은 EDS 매핑에서 알 수 있듯이 균일하게 분포된 리튬과 촉매로 구성된 것으로 보입니다.
lithia/Li2를 포함하는 전지의 전기화학적 특성 RuO3 나노복합체는 Li2의 효과를 조사하기 위해 조사되었습니다. RuO3 촉매. 그림 2는 lithia/Li2의 전압 곡선과 주기적 성능을 보여줍니다. RuO3 전류 밀도가 10 mA일 때 나노복합체 g −1 . 리튬이 과충전되면 산소의 산화 상태가 -2(Li2 O 형식) ~ 0(O2 가스) [25,26,27]. 과충전이 발생하지 않는 한계 용량을 확인하기 위해 충방전 용량을 300, 400, 500, 600mAh g −1 로 제한하였다. , 리시아의 질량을 기준으로 계산됩니다. 그림 2a-d와 같이 lithia/Li2의 전압 곡선 RuO3 나노복합체는 두 주기 동안 모든 제한된 용량에서 안정적인 것으로 보입니다. 용량이 300mAh로 제한되었을 때 g −1 , 좁은 전압 범위(3.5 ~ 2.7 V)가 발생합니다. 그러나 제한된 용량이 증가함에 따라 전압 범위도 증가합니다. 용량이 600mAh로 제한되었을 때 g −1 , 전압은 충전 시 ~ 4.0 V까지 상승하고 방전 시 ~ 2.0 V로 감소했습니다. 그림 2e–h는 lithia/Li2의 주기적 성능을 나타냅니다. RuO3 동일한 조건에서 나노복합체. 나노복합재는 300–500mAh g −1 의 제한된 용량에서 순환할 때 안정적입니다. . 그러나 600mAh g −1 으로 용량을 늘리면 , 용량은 13 주기 후에 점차 감소하기 시작했습니다. 이것은 lithia/Li2의 안정적인 용량 범위를 나타냅니다. RuO3 나노복합체는 600mAh g −1 미만입니다.; 과충전으로 인해 용량이 불안정해질 수 있습니다. 리시아(Li2 O) 충전되어 응축된 상태(고체)로 유지되며, 리튬의 산소는 O 2- 에서 변경되었습니다. O x까지 - (0.5 ≤ x <2). 그러나 리튬이 고체 형태를 유지하기 위한 한계 이상으로 충전되면 산소의 산화 상태가 0에 가까워져 산소 가스가 발생할 수 있다. 이 프로세스는 사이클링 동안 용량 페이딩으로 이어집니다. 그러나 리티아(Li2 오, 오 2− ) 과산화물(Li2 O2, O 1− ), 리튬의 이론적 용량은 897mAh g −1 입니다. [26, 27]. 산화환원 반응이 O 0.5- 를 생성하는 경우 (LiO2 ), 리튬의 이론적 용량은 1341mAh g −1 로 증가합니다. [29]. 따라서 관찰된 용량이 600mAh g −1 미만인 경우 , lithia/Li2의 lithia 용량 제한 RuO3 나노복합체에 도달하지 못했습니다.
<그림>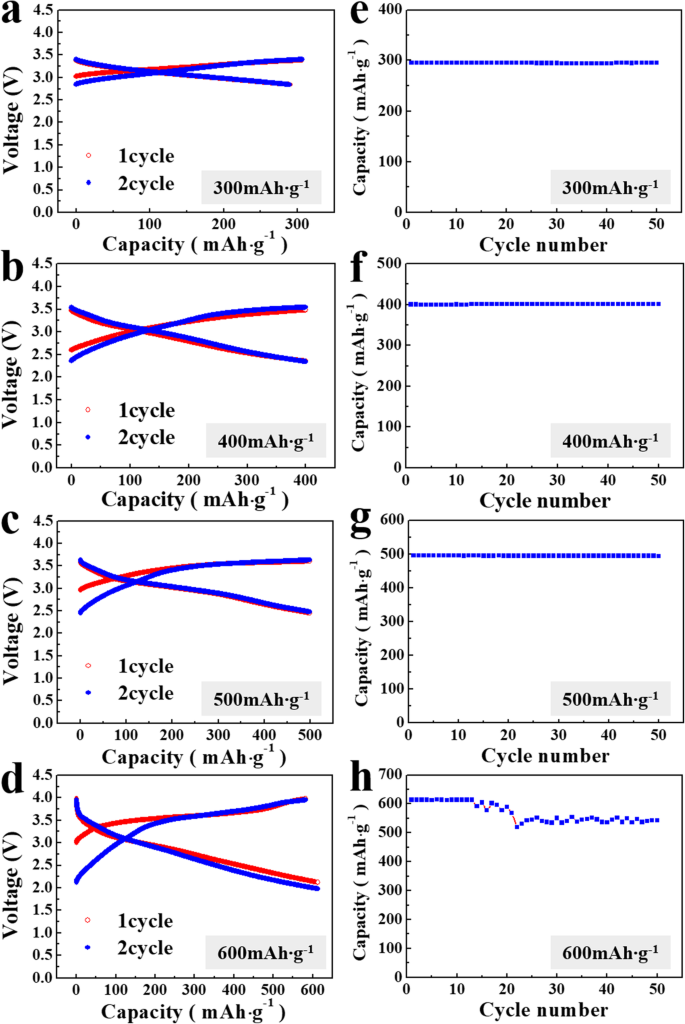
lithia/Li2의 전압 곡선 RuO3 용량이 a로 제한되는 경우 나노복합체 300, b 400, c 500 및 d 600mAh g −1 ; 용량 제한이 일 때 순환 , f , 지 , 및 h , 각각
촉매가 리튬을 활성화하고 불안정한 반응 생성물(예:Li2 O2 및 LiO2 ). lithia/Li2의 낮은 가용 용량 RuO3 리튬의 이론적 용량과 비교한 나노복합체는 나노복합체의 촉매가 전체 용량을 추출할 만큼 충분히 리튬을 활성화하지 않는다는 것을 의미할 수 있습니다. 반응 생성물의 안정화는 또한 리튬계 캐소드의 용량 안정성에 상당한 영향을 미친다. 반응 생성물(예:Li2 O2 및 LiO2 ) 리티아의 산화환원 반응으로 형성된 반응성이 매우 높다. 따라서 전해질과 같은 다른 물질과 반응하여 다른 물질로 변형되기 쉽습니다. 이러한 부반응을 억제하고 반응 생성물을 안정화시키는 것도 촉매의 기능입니다. 도 2h에 도시된 바와 같이, 특정 사이클 수 후 용량 감소는 사이클링 동안 반응 생성물의 불안정성과 관련될 수 있다(즉, 600mAh g -1 ). lithia/Li2의 Ru 기반 촉매의 한계를 넘어설 수 있습니다. RuO3 나노복합체는 반응 생성물을 안정화시킬 수 있습니다.
lithia/Li2의 용량이지만 RuO3 나노복합체는 이론적인 용량에 도달하지 못하고 안정적인 용량(> 500mAh g −1 리튬의 질량 기준)은 밀링 공정(<400 mAh g -1 )으로 제조된 이전에 보고된 리튬 기반 음극과 비교하여 우수합니다. ) [25,26,27,28]. 이것은 Li2 RuO3 분해된 상(예:Ru)은 리튬을 효과적으로 활성화하고 사이클링 동안 반응 생성물을 안정화합니다. 촉매가 리튬과 함께 더 완전하게 분산되면 더 나은 촉매 활성을 나타낼 수 있습니다. 기계적 밀링의 한계로 인해 화학적 준비(기계적 밀링보다)와 같은 다른 방법을 고려해야 합니다.
lithia/Li2의 용량 및 주기적 성능 RuO3 나노복합체는 다른 전류 밀도를 사용하여 더 자세히 분석되었습니다. 그림 3a는 10, 30, 100 및 200 mA g −1 의 전류 밀도에서 나노복합체의 초기 전압 프로파일을 비교합니다. 500mAh g −1 의 제한된 용량 . 전압 프로파일의 모양은 전류 밀도가 증가해도 크게 변하지 않습니다. 두 시스템 모두 ORR에 유사하게 뿌리를 두고 있지만 나노복합체를 포함하는 전지의 과전위는 일반적인 리튬 공기 전지보다 훨씬 낮습니다. 리튬-공기 시스템은 충방전 시 기체와 응축상 사이의 양극 구조가 크게 변화하는 반면, 리튬 기반 음극은 산화환원 반응을 진행하여 응축상(고체)을 유지합니다. 이는 충전 및 방전 중 전자 및 이온 전달 및 상 변형으로 인한 에너지 장벽의 감소로 이어지며 결과적으로 리튬 기반 시스템의 과전위가 상대적으로 낮습니다.
<사진>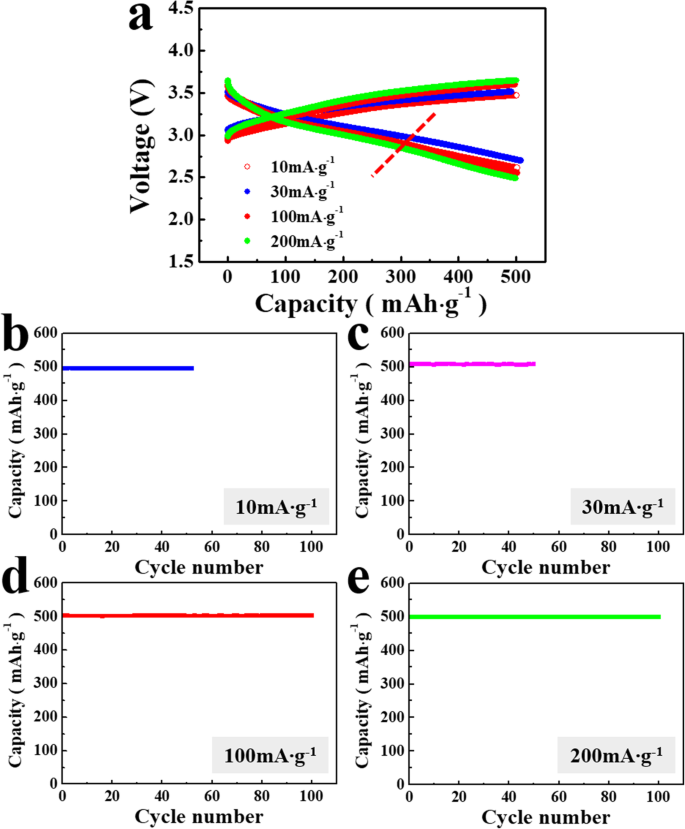
lithia/Li2의 전압 프로파일 및 주기적 성능 RuO3 10, 30, 100 및 200mA의 전류 밀도에서 나노복합체 g −1 500mAh g −1 의 제한된 용량 . 아 전압 프로파일; b의 주기적 성능 10 mA g −1 , ㄷ 30 mA g −1 , d 100 mA g −1 , 및 e 200 mA g −1
lithia/Li2의 주기적 성능 RuO3 나노복합체는 500mAh g −1 의 제한된 용량에서 안정적입니다. (그림 3b-e). 사이클링 전과 선택된 사이클(즉, 1번째, 50번째 및 100번째 사이클) 후에 나노복합체를 포함하는 세포의 Nyquist 플롯을 분석하여 사이클링 동안 임피던스 값을 결정했습니다. 도 4에 도시된 바와 같이, 나이퀴스트 플롯의 반원 부분의 크기는 사이클링 전에 측정된 것과 비교하여 1번째 사이클 이후에 약간 증가한다. 이것은 일반적으로 전하 이동 저항과 고체 전해질 계면에 기인하는 임피던스 값이 초기 주기 동안 크게 변하지 않음을 나타냅니다. 50번째 사이클 이후에는 셀의 임피던스가 증가하지만 100번째 사이클 이후에는 임피던스의 증가가 덜 두드러져 사이클 동안 셀의 임피던스가 다소 증가하지만 상대적으로 안정적임을 시사합니다.
<그림>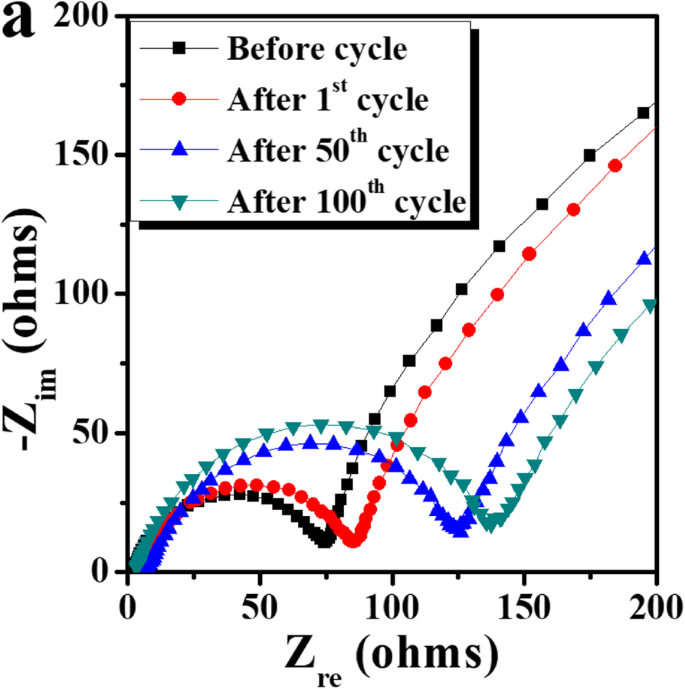
lithia/Li2를 포함하는 세포의 Nyquist 플롯 RuO3 사이클링 전과 선택된 사이클 후 나노복합체(첫 번째, 50번째 및 100번째 사이클)
나노복합체의 방전곡선 분석(Fig. 3a)은 2.9에서 2.7 V 근처의 기울기에서 약간의 변화를 보여주며(Fig. 3a, 빨간색 선으로 표시), 이는 전류밀도가 높을 때 더 명확하게 나타납니다. lithia의 ORR을 고려할 때, red line 위의 고전압 영역은 peroxo-like (O2 ) n - 충전 과정에서 형성된 종, 저전압 영역은 O 2p 홀의 중성화에 기인한다[27]. 리튬의 순수한 산화환원 반응으로 인한 방전 용량이 3.1 V 미만의 낮은 전압 범위에서 보여졌기 때문에 용량의 일부가 ~ 3.1 V 이상에서 관찰된다는 점에 주목해야 합니다(그림 3a)[25,26,27, 28,29]. 따라서 lithia/Li2의 용량 RuO3 ~ 3.1 V 이상의 나노복합체는 리튬이 아닌 다른 재료에 기인할 수 있습니다. 리2 RuO3 lithia/Li2에 들어 있습니다. RuO3 나노복합체는 상당한 방전 용량을 가지고 있기 때문에 전체 용량에 기여할 수 있습니다. Li2의 충방전 특성을 관찰하려면 RuO3 , Li2를 포함하는 셀 RuO3 음극이 준비되고 전압 곡선이 측정됨에 따라. 그림 5a에서 볼 수 있듯이 충분한 충전을 위해서는 ~4.3 V의 고전압이 필요하며 대부분의 방전 용량은 3.1 V 이상에서 발생합니다. 그림 5b는 lithia/Li2의 방전 프로파일을 비교한 것입니다. RuO3 나노복합체 및 Li2 RuO3 , 두 음극의 전압 범위가 다름을 보여줍니다. 따라서 lithia/Li2 방전 용량의 대부분은 RuO3 나노복합체는 Li2의 용량이 아니라 리튬의 산화환원 반응과 관련이 있습니다. RuO3 . 그러나 lithia/Li2의 일부 용량이 RuO3 ~ 3.1 V 이상에서 관찰된 나노복합체는 Li2의 산화환원 반응으로 인한 것입니다. RuO3 , 그러나 상당한 양의 Li2 RuO3 밀링 과정에서 Ru로 분해됩니다. 또한, 잔류 Li2 RuO3 그림 1a에서 확인된 바와 같이 비정질 상으로 변경되었습니다.
<그림>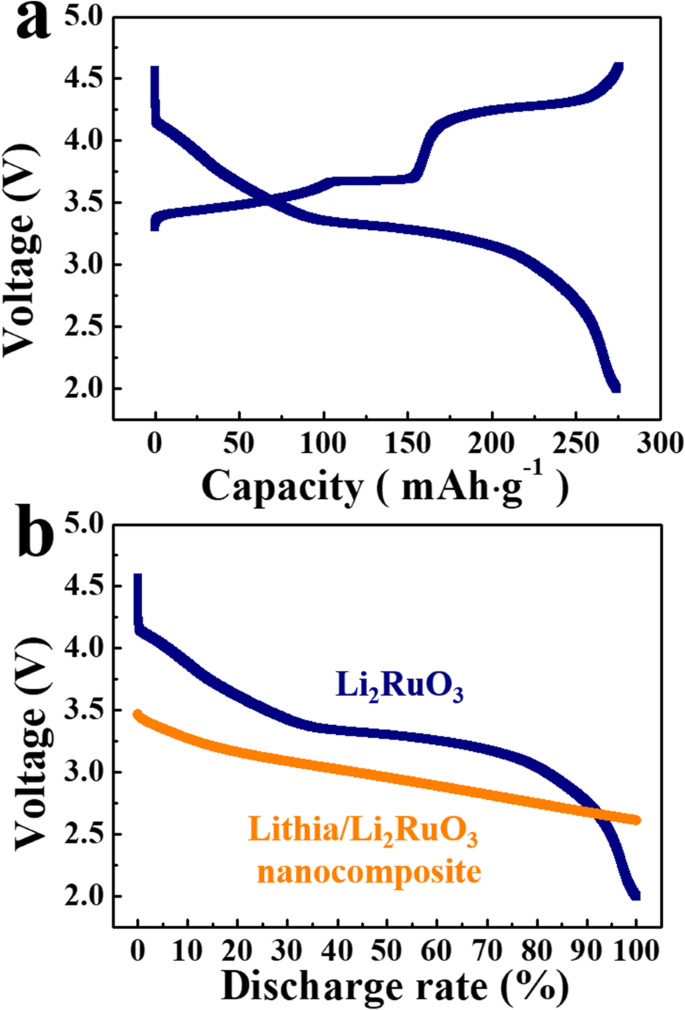
아 Li2의 충방전 프로필 RuO3 . ㄴ lithia/Li2의 방전 프로파일 비교 RuO3 나노복합체 및 Li2 RuO3
충방전 과정에서 일어나는 산화환원 반응을 설명하기 위해 lithia/Li2 RuO3 XPS를 사용하여 서로 다른 충전 및 방전 상태의 나노복합체를 분석했습니다. 그림 6은 lithia/Li2의 O 1 및 Ru 3d 스펙트럼을 보여줍니다. RuO3 사이클 동안 나노복합체. 측정을 위해 나노복합체를 350 및 500 mAhg −1 로 충전했습니다. (완전히 충전된 것으로 지정), 250 및 500mAh g −1 로 방전 , 각각. 도 6a에 도시된 바와 같이, 나노복합체의 O 1 s 스펙트럼은 충전 과정에서 변화하였다. ~ 531.5 eV 및 ~ 533.5 eV에서 큰 피크는 탄산 용매의 분해로 인한 산소 침착된 종에 기인합니다[39, 40]. 샘플이 350mAh g −1 로 충전된 경우 , 격자 O 2− ~ 529.5 eV(하늘색으로 표시)에서 피크가 감소하고 ~ 531 eV(빨간색으로 표시)에서 새로운 피크가 나타났습니다. 셀이 500mAh g −1 까지 완전히 충전됨에 따라 새로운 피크가 증가했습니다. , 격자 O 2− 의 감소와 함께 정점. 이 새로운 피크는 퍼옥소 유사(O2 ) n - 격자 산소의 ORR을 통한 종 (O 2- ). 이러한 종은 불안정하고 액체 전해질에 쉽게 용해됩니다. 그러나 XPS 스펙트럼은 고체 구조에 존재하는 것으로 나타났으며 이는 촉매로 인한 것일 수 있습니다. 시료가 방전되면 퍼옥소와 관련된 피크(O2 ) n - 종 감소 및 거의 사라짐(완전히 500mAh g −1 방전 시 ), 이는 격자 O 2− 의 증가를 동반합니다. 정점. 이는 lithia/Li2에서 산소에 의한 음이온성 산화환원 반응이 가역적으로 진행됨을 확인시켜줍니다. RuO3 충방전 과정에서 나노복합체. 그림 6b는 Ru 3d5/2와 함께 Ru 3d 스펙트럼을 보여줍니다. 도 6c에서 확대된 단면; Ru 3d 피크는 사이클링 동안 현저하게 이동하지 않으며, 이는 Ru의 산화 상태가 변경되지 않음을 나타냅니다. 이것은 Li2의 용량 때문에 주목할 만합니다. RuO3 양이온 산화환원 반응에 기인하는 것은 음이온(산소) 산화환원 반응 외에 Ru의 산화 상태 변화를 동반한다. 사이클링 중 Ru 3d 피크 이동에 대한 이전 보고서는 Li2의 XPS 분석을 통해 명확하게 관찰되었습니다. RuO3 [40]. 그러나 우리의 결과에 따르면 Ru에 의한 양이온 산화환원 반응은 lithia/Li2의 방전 용량에 거의 기여하지 않습니다. RuO3 나노복합체. 앞서 논의한 바와 같이 lithia/Li2 용량의 상당 부분이 RuO3 나노복합체는 Li2의 용량에서 나옵니다. RuO3 왜냐하면 Li2 RuO3 나노복합체에서 대용량을 표시할 수 있는 능력이 있다. 그러나 Li2의 용량이 RuO3 이는 주로 Ru의 양이온 산화환원 반응에 기인하며, lithia/Li2에 대한 용량의 대부분이 RuO3 나노복합체는 리튬의 순수한 산소 산화환원으로부터 생성됩니다. 무정형 Li2의 산소가 RuO3 구조는 또한 결정질에서 비정질 상으로의 전이가 전기화학적 성능을 변화시킬 수 있기 때문에 ORR에 참여할 수 있습니다. 더욱이, Li2의 분해로부터 형성된 리튬 산화물 종 RuO3 밀링하는 동안 용량도 가질 수 있습니다. ~ 3.1 V 이상에서 관찰된 용량의 작은 부분은 이러한 추가 산화환원 반응과 관련이 있을 수 있습니다.
<그림>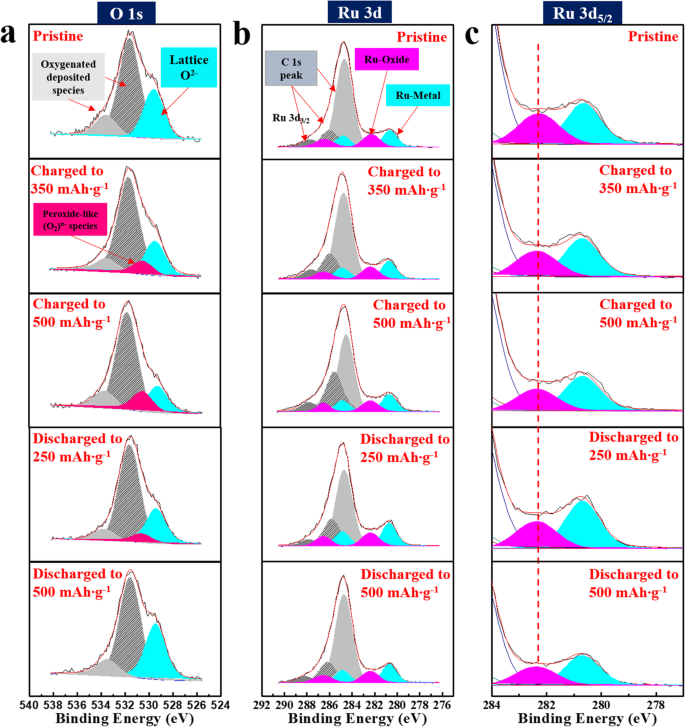
lithia/Li2의 XPS 스펙트럼 RuO3 다양한 충전 및 방전 지점에서 측정된 나노복합체. 측정을 위해 나노복합체를 350 및 500mAh g −1 로 충전했습니다. (완전 충전으로 지정됨), 250 및 500mAh g −1 으로 방전됨 완전 충전 후. 아 O 1 s 스펙트럼, b Ru 3d 스펙트럼 및 c Ru 3d5/2 스펙트럼
A lithia/Li2 RuO3 밀링 공정을 통해 나노복합체를 제조하였으며, 구조적 및 전기화학적 성능을 특성화하였다. 리2 RuO3 Li2와 같은 불안정한 반응 생성물을 안정화시키고 리튬을 활성화하기 위한 새로운 촉매로 사용되었습니다. O2 및 LiO2 . 밀링 과정에서 상당한 양의 Li2 RuO3 Ru로 분해되고 남아있는 것은 비정질 상으로 변형됩니다. 결정질 리튬도 밀링 과정에서 비정질 상으로 변경되었습니다. 리시아/Li2 RuO3 나노복합체는 제한된 용량이 500mAh g −1 에 도달할 때까지 안정적인 순환 성능을 나타냅니다. . 그러나 제한된 용량을 600mAh로 늘렸을 때 g −1 , 사이클링은 불안정성을 초래하여 셀이 안정적으로 충전 및 방전될 수 있는 한계를 초과하여 과충전되었음을 나타냅니다. XPS 분석에서 lithia/Li2의 용량이 RuO3 나노복합체는 주로 퍼옥소 유사(O2 ) n - 종. 대조적으로, Ru 3d 스펙트럼은 사이클링 동안 눈에 띄게 변화하지 않았으며, 이는 lithia/Li2의 용량에 대한 양이온(Ru) 산화환원 반응의 기여를 확인시켜줍니다. RuO3 나노복합체는 무시할 수 있습니다. 따라서 lithia/Li2 용량의 대부분은 RuO3 나노복합체는 리튬의 산소 산화환원에 기인합니다. 그러나 일부 용량, 특히 ~ 3.1 V 이상의 고전압 영역에서의 용량은 Li2의 분해로 형성된 리튬 산화물 종과 같은 나노복합재에 존재하는 다른 물질과 관련될 수 있습니다. RuO3 . 우리는 lithia/Li2를 믿습니다. RuO3 나노복합체는 고용량 리튬 기반 음극 개발을 위한 좋은 후보가 될 수 있습니다. 이 작업이 lithia/Li2에 대한 이해에 기여할 수 있기를 바랍니다. RuO3 나노복합체 및 리튬 기반 음극 연구를 자극합니다.
저자는 독자가 자료, 데이터 및 관련 프로토콜을 사용할 수 있으며 분석에 사용된 모든 데이터가 이 기사에 포함되어 있음을 선언합니다.
산소 산화 환원 반응
X선 회절법
X선 광전자 분광법
에너지 분산 X선 분광기
폴리불화비닐리덴
투과전자현미경
나노물질
2015년에 처음으로 합성된 보로펜은 해부학적으로 얇은 결정질 2D 붕소 시트로 이미 전 세계 과학자들의 관심을 사로잡았습니다. 새로운 경이로운 재료로 설명됨 고유한 이방성 유연성과 금속성으로 인해 배터리, 센서 및 촉매 화학에 혁명을 일으킬 가능성이 있습니다. 이 기사는 보로펜의 합성, 특성 및 잠재적 응용을 요약합니다. 합성 및 속성 그동안 그래핀은 단일 형태를 취하고 보로펜은 많은 격자 구성을 가질 수 있는 다형체입니다. 이론적으로 각각 다른 특성을 가진 1000가지 이상의 형태의 보로펜이 있을 수 있습니다. 보로펜은 고체
반응 사출 성형(RIM)은 일반적으로 크고 복잡한 형상을 제조하는 데 사용되는 제조 공정입니다. 사출 성형과 달리 RIM은 열경화성 재료를 사용하고 열가소성 수지를 사용하지 않습니다. 이러한 이유로 폴리우레탄 고형물 및 발포체는 가장 일반적으로 RIM과 연관됩니다. 이 게시물에서는 제품 디자인에 사용할 수 있는 5가지 유형의 RIM 재료에 대해 자세히 알아보겠습니다. 탄성 폴리우레탄 탄성 폴리우레탄은 이소시아네이트와 폴리올의 반응을 통해 형성되어 이 재료를 진정한 폴리머로 만듭니다. 캐스트 재료와 유사하게 엘라스토머 RIM