나노물질








나노기술은 나노크기에서 물질의 크기와 형태를 제어함으로써 다양한 환경적 문제를 해결할 수 있는 능력을 가진 첨단 과학 분야이다. 탄소 나노물질은 비독성 특성, 높은 표면적, 더 쉬운 생분해성 및 특히 유용한 환경 개선 때문에 고유합니다. 수중 중금속 오염은 주요 문제이며 인간의 건강에 큰 위험을 초래합니다. 탄소나노소재는 중금속으로 오염된 물의 고도처리에 활용될 수 있는 우수한 물리화학적 특성으로 인해 더욱 주목받고 있다. 탄소나노튜브, 풀러렌, 그래핀, 산화그래핀, 활성탄과 같은 탄소나노물질은 표면적이 크고 나노크기가 크며 다양한 기능을 이용할 수 있기 때문에 물에서 중금속을 제거할 수 있는 잠재력이 크며 화학적으로 쉽게 변형되고 쉽게 변형될 수 있습니다. 재활용. 이 기사에서 우리는 중금속으로 오염된 물의 처리에서 이러한 탄소 나노물질의 적용에 대한 최근의 발전을 검토하고 환경 개선에서의 적용을 강조했습니다. 탄소 기반 나노 물질의 독성 측면도 논의되었습니다.
오염은 자연적 과정을 방해하거나 살아있는 유기체와 환경에 악영향을 미치는 바람직하지 않은 화학 물질/물질의 존재로 지칭됩니다[1,2,3]. 산업화와 인구의 엄청난 증가는 도시화의 증가로 인해 놀라운 속도로 오염을 증가시킵니다[2, 4]. 물, 토양, 공기의 질을 개선하는 것은 현대의 엄청난 도전입니다. 환경 오염 물질의 식별 및 처리 및 예방은 환경 보호의 핵심 단계입니다. 재료과학은 청정환경 목표를 실현하는 데 중요한 역할을 하고 있으며, 재료과학 기술은 지난 10년 동안 특히 나노재료[1, 5]에 기하급수적으로 발전했습니다. 순수하고 깨끗한 물은 산업화로 인해 점점 부족해지고 있으며, 특히 개발도상국을 중심으로 세계는 깨끗한 물 부족에 직면해 있습니다[6]. 수질 오염 물질은 유기물, 박테리아, 바이러스, 염료 및 납, 카드뮴, 아연, 니켈, 비소, 크롬 및 수은과 같은 중금속 이온이 될 수 있으며 자연 분해되지 않아 인체 건강에 큰 위험을 초래합니다. 중금속 이온은 암, 신장 손상, 간염, 유산, 빈혈, 뇌병증, 신증후군과 같은 많은 부작용을 일으킬 수 있습니다[7,8,9,10]. 납 이온은 일반적으로 산성 납 배터리, 종이, 유리 및 연마 산업의 금속 광산 산업에서 환경으로 방출됩니다. 카드뮴은 일반적으로 배터리, 태양광 전지, 야금 공정 및 직물 공장의 전기 도금 설계에서 배출되는 물에서 발견됩니다[11]. 니켈 이온은 장신구 쓰레기, 지퍼, 시계, 동전 등과 접촉하면 피부병을 일으킬 수 있습니다. 크롬 금속 이온(VI)은 간 손상, 신장염, 위장 장애와 같은 질병을 유발하며 Cr(VI) 이온도 주요 원인입니다. 코 점액 궤양 [12]. 그림 1은 탄소나노물질(그래핀)에 대한 중금속 이온의 흡착을 보여주고, 그림 2는 환경의 다양한 중금속 오염원을 보여줍니다. 이러한 심각한 부작용 때문에 물에서 중금속 이온을 제거하는 것은 이러한 문제가 있는 건강 문제로부터 인명을 구하는 데 가장 중요합니다. 독성 금속 이온은 이온 교환, 역삼투, 침전 여과, 생체 흡착, 응고 및 추출과 같은 다양한 방법으로 제거할 수 있습니다[13, 14]. 흡착은 미량의 중금속 이온을 제거하기 위해 비용 효율적이고 매우 효율적이며 조작이 간편하기 때문에 가장 좋은 방법으로 간주됩니다[15]. 식물 흡착제 및 유기 천연 재료, 특히 물 소독 및 중금속 이온 제거에 널리 적용되는 부식산과 같은 다양한 재료가 수처리에 적용되었습니다[8, 16, 17, 18, 19]. Wang et al. 수처리에서 부식산과 그 나노복합체를 종합적으로 검토했습니다[20].
<그림>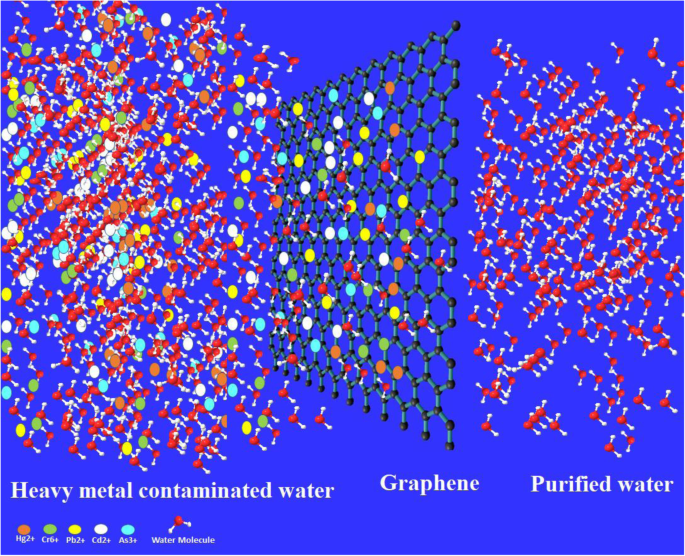
그래핀 및 기타 탄소 기반 재료를 사용한 중금속 오염 정수 공정도 동일하게 수행할 수 있음을 보여주는 그래픽 초록
<그림>
환경 중금속 오염의 원인
나노 기술 플랫폼은 환경 과학, 건강 과학, 전자, 산업 분리, 휴대용 수처리 대규모/소규모 플랜트, 촉매, 에너지 저장 및 에너지 생성과 같은 거의 모든 분야에서 응용 프로그램을 찾습니다[21,22,23]. 나노 물질은 나노 흡착제의 높은 표면적과 화학적 변형 및 더 쉬운 재생 능력으로 인해 오염된 물을 정화하기 위한 특별한 플랫폼을 제공합니다. 나노 물질은 유기물, 금속 이온, 생물학적 오염 물질 및 물에서 비소와 같은 다양한 유형의 오염 물질을 제거하기 위해 점점 더 많이 이용되고 있습니다[24,25,26,27]. 그래핀, 산화그래핀, 탄소나노튜브, 풀러렌, 활성탄과 같은 탄소나노물질은 화학적, 기계적, 열적 특성이 탁월하여 에너지 저장, 센서, 전자, 정수, 약물 전달, 질병 진단 등에 널리 사용되어 왔다. 전기적 특성. 이 기사에서 우리는 중금속 이온 오염수 정화에 탄소 나노 물질, 즉 풀러렌, 탄소 나노튜브(CNT), 그래핀, 산화 그래핀 및 활성탄의 최신 응용 프로그램을 검토하려고 했습니다.
중금속은 일반적으로 원자량에 따라 정의됩니다. 그러나 중금속이라는 용어는 생물에 유독한 요소라고도 합니다[28]. 특정 중금속은 다양한 형태와 용량으로 인체 및 기타 생물에 치명적입니다(표 1). 흔히 중금속은 독성이 있는 것으로 생각됩니다. 그러나 더 가벼운 금속, 예를 들어 베릴륨 및 리튬도 마찬가지로 치명적일 수 있습니다. 철과 Cr(III)과 같은 일부 중금속이 기본이기 때문에 모든 중금속이 건강에 유해한 것은 아닙니다. 가장 일반적으로 알려진 독성 금속은 Pb, Cd, Cr, Mn, Hg, As 및 방사성 금속입니다. 방사성 금속은 방사선 독성과 화학적 독성을 모두 가지고 있습니다. 중금속 독성은 주요 위협으로 밝혀졌으며 그와 관련된 많은 건강 위험이 있습니다. 이러한 금속의 치명적인 영향은 생물학적 역할이 없다는 사실입니다. 그러나 그들은 신체의 한 요소로 모방하고 대사 및 기타 생물학적 과정을 방해할 수 있습니다. 알루미늄과 같은 일부 금속은 배설 시스템에 의해 쉽게 제거될 수 있지만 특정 금속은 먹이 사슬과 신체에 축적됩니다. 금속 유발 독성은 용량, 노출 경로 및 접촉 시간(예:급성 또는 만성)에 따라 다릅니다. 다양한 중금속과 관련된 독성에 대한 자세한 내용은 아래에 나와 있습니다.
수은(Hg)은 원자 번호 80의 d-블록 원소이며 표준 조건에서 액체 형태입니다. 수은은 진사라고 불리는 황화수은의 퇴적물에서 발견됩니다. 수은 오염은 제약 산업, 펄프 및 종이 보존, 가성 소다 생산 산업, 농업 산업 등에 의해 발생합니다.[47] 수은은 환경에서 가장 유독한 중금속이며, 수은 중독은 acrodynia라고도 알려진 핑크 병이라고 합니다. 수은은 유기 및 무기 화합물과 결합할 수 있습니다. 어떤 형태로든 증가된 수은 노출 수준은 신장, 뇌, 발달 중인 태아 등에 손상을 줄 수 있습니다.[48]. 환경 보호 기관은 메틸 수은과 염화 수은을 발암 물질로 선언했습니다. 수은 노출은 또한 폐 손상, 피부 발진, 기억력 문제 및 탈모를 유발할 수 있습니다. 세계보건기구(WHO)는 수은 함량이 낮은 식수에 대한 기준을 0.01 mg/l로 설정했습니다[29].
납(Pb)은 원자번호 82번의 원소로 공기의 작용에 의해 회색으로 변하는 은빛 푸른빛을 띠는 중금속으로 여겨진다[30]. 납 오염의 원인은 다양하며 주로 배터리 산업 폐기물, 비료 및 살충제, 금속 도금 및 마감 작업, 배기 가스, 가솔린 첨가제, 자동차 안료 및 광석 제련입니다. 이 중독성 금속은 널리 사용되기 때문에 전 세계적으로 환경 및 건강 문제가 되고 있습니다[31]. 납(Pb)은 EPA(Environmental Protection Agency)에서 선언한 발암성 요소입니다. 납 중독은 독성에 대해 사용되는 용어이며 급성 또는 만성일 수 있습니다. 납 중독은 정신 지체, 자폐증과 같은 선천적 기형, 알레르기, 난독증, 마비, 뇌 손상 및 신장 손상을 유발할 수 있으며 사망에 이를 수도 있습니다[32].
비소는 원자번호 33번의 준금속 원소이며 일반적으로 황, 일부 다른 금속, 철, 칼슘, 나트륨, 구리의 염과 결합하여 광물 형태로 존재하며 순수한 원소 형태로도 존재합니다[33]. 물은 비소 기반 살충제, 천연 광물 퇴적물, 비소 기반 시약 또는 화학 물질의 부적절한 폐기로 인해 오염됩니다. 비산 및 비소 형태의 비소는 환경과 생물에 치명적입니다. 비소는 세포의 설프히드릴 그룹과 상호작용하여 호흡 기능 장애를 일으키고 유사분열 및 세포 효소에 영향을 주어 세포의 원형질을 교란합니다.
카드뮴은 원자번호 48번으로 12족의 수은과 아연과 유사한 화학적 성질을 갖는 청백색의 연금속이다[30]. 광석, 전기도금, 배터리, 가소제, 합금, 안료, 원자력 산업 및 담배 연기를 제련하여 생산됩니다. 일반적으로 카드뮴은 환경에 낮은 수준으로 존재합니다. 그러나 산업 폐기물은 이러한 수준을 크게 증가시켰습니다. 카드뮴 유발 독성은 신장, 호흡기계 및 골격에 손상을 일으킬 수 있으며 인간에게 발암성입니다[30, 33]. 카드뮴은 독성 물질 및 질병 등록부(ATSDR)에 의해 7번째로 가장 유독한 금속으로 선정되었습니다[34].
크롬(Cr)은 원자번호 24번의 원소로 강철 같은 회색을 띤다[35]. 크롬은 2가, 4가, 5가 및 6가와 같은 다양한 상태에서 발생합니다. 그러나 3가 및 6가 형태가 가장 안정적입니다. 크롬(III)은 인간과 동물에게 필수적인 영양 보충제입니다[35]. 그러나 크롬(VI) 형태는 독성이 강하고 본질적으로 발암성이 있습니다[36, 37]. 크롬은 다양한 출처(예:주로 야금 및 화학 산업에서 배출되는 폐수 및 공기)의 환경 매트릭스(공기, 물 및 토양)에서 생성됩니다. 6가 크롬 Cr(VI)은 인체 발암 물질로 확립된 산업 오염 물질이다[38, 39]. 지하수 및 지표수의 Cr(VI) 농도는 초과되었으며 세계 보건 기구(WHO)는 리터당 50 μg의 한계를 설정했습니다[40].
아연(Zn)은 원자번호 30번의 주기율표 2족에 속하는 원소이다. 아연은 인간에게 필수적인 미량 금속이지만 아연을 과도하게 흡수하면 철 흡수를 억제할 수 있습니다. 아연 이온은 식물, 척추동물, 무척추동물 등에 매우 독성이 있습니다. [41,42,43].
3차원이 모두 100 nm 미만인 나노물질을 0차원(0-D) 나노물질이라고 합니다. 풀러렌과 양자점을 예로 들 수 있습니다[44]. 100 nm보다 큰 한 치수와 100 nm보다 작은 두 치수만 갖는 나노물질을 탄소와 티타늄의 나노튜브와 같이 1차원(1-D) 나노물질이라고 합니다[45, 46]. 2차원이 100 nm보다 큰 나노물질을 2차원 나노물질이라고 하며, 대표적인 예로 그래핀을 들 수 있다. 모든 치수가 100 nm보다 큰 3차원 재료를 3차원(3-D) 재료라고 합니다. 그 예로는 흑연과 일부 나노재료 복합재료가 있다[46]. 그림 3은 풀러렌 0-D, 단일벽 탄소 나노튜브 1-D, 그래핀 2-D 및 흑연 3-D와 같이 치수가 다른 몇 가지 대표적인 유명한 구조 탄소 재료를 보여줍니다.
<그림>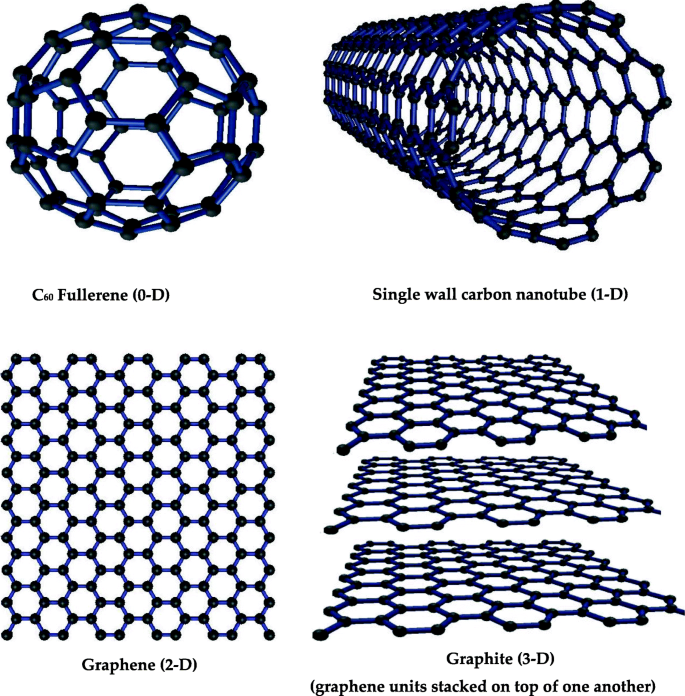
다양한 치수의 탄소 나노 물질의 예
풀러렌은 1985년 성간 먼지에서 발견되었으며, C20 + m의 공식으로 표시되는 닫힌 갇힌 오각형 및 육각형 고리 구조를 가지고 있습니다. m 정수[49]입니다. 그들은 소수성 특성, 높은 전자 친화도 및 높은 표면 대 부피 비율 및 표면 결함을 가지고 있습니다. 이러한 독특한 물리화학적 특성으로 인해 반도체, 전자, 생물 의학, 태양 전지, 센서, 화장품, 인공 광합성 및 표면 코팅과 같은 다양한 응용 분야에 이상적인 재료입니다[50,51,52]. Brunet et al. 친수성 기능화된 풀러렌(C60 ) 광촉매 과정을 이용하여 물에서 병원성 미생물을 죽이는 데에도 적용되었습니다. 풀러렌은 탄소와 수소의 결합 에너지가 더 낮기 때문에 풀러렌 분자가 쉽게 C-C 결합으로 C-H로 전환될 수 있기 때문에 수소 저장을 위한 이상적인 청정 친환경 물질입니다[27]. 풀러렌은 화학 및 케이지 분자 구조로 인해 최대 저장 6.1% 수소를 갖는 것으로 보고되었으며 풀러렌 구조는 더 높은 C-C 결합 에너지로 인해 쉽게 되돌릴 수 있습니다[3, 53, 54]. 탄소 전도성 층은 슈퍼 커패시터의 전극 표면에 적용되며 이들의 커패시턴스는 표면적, 기공 크기 분포 및 전기 전도도에 의존합니다[55, 56]. 탄소 기반 나노 물질은 더 높은 표면적 때문에 기존의 물질보다 더 높은 전기 전도도를 제공합니다[57]. 풀러렌 기반 복합 재료는 135.36Fg − 1 의 더 높은 비정전용량을 나타내는 것으로 보고되었습니다. 풀러렌과 혼성화되지 않은 순수한 그래핀 물질보다 이 외에도 플러렌 기반 복합재료는 1000회 충방전 순환 후에도 92.35%의 더 나은 유지 시간 비율을 보였다[58]. 풀러렌은 리튬이온 배터리의 음극으로도 활용되고 있으며, 비분해성 금속 음극을 대체하여 효율을 높여 효율성과 친환경적인 소재로 활용되고 있습니다. 풀러렌의 물리화학적 특성은 또한 풀러렌을 수성 매질에서 다양한 종의 추출에 적합한 후보로 만듭니다[59, 60]. Pickering et al. 수용성 풀러렌 화합물을 설계하고 가시광선 및 자외선 조사시 물에서 반응성 산소종(ROS)을 생성하는 증감제로 성공적으로 적용했습니다. ROS는 수중의 유기 오염물질을 광분해시킬 수 있으며, 이 외에도 수용성 풀러렌(풀러롤)도 항산화제 역할을 합니다. 가장 중요한 것은 풀러롤이 광분해 기능을 수행한 후 물에서 쉽게 제거될 수 있다는 것입니다[53].
탄소 나노클러스터 사이의 공간/결함에서 흡착물의 침투에 의해 풀러렌이 흡착된 종은 결함에 더하여 낮은 응집 경향 및 넓은 표면적을 갖는 나노 물질로부터 중금속 이온의 흡착에 적용하기에 유용한 나노 물질로 여겨진다. 물 [61, 62]. Alekseeva et al. Cu 2+ 제거를 위한 풀러렌 및 나노복합 폴리스티렌 필름의 비교 연구 수행 이온; 그들은 풀러렌이 더 나은 효율성을 보인다는 것을 발견했습니다[60]. 그들은 또한 풀러렌이 Cu 2+ 에 대한 Langmuir 흡착 모델을 따른다는 것을 발견했습니다. 이온 [60]. 그들은 Cu 2+ 풀러렌의 제거 효율은 첫 번째 경우에 더 높고 Cu 2+ 의 평형 등온선 풀러렌에 대한 흡착은 Langmuir 모델에 맞습니다. 풀러렌은 물 흡착 응용 분야에 큰 잠재력을 가지고 있지만 비용이 너무 높아 활용이 제한됩니다. 그러나 미량의 풀러렌은 흡착 효율을 높이기 위해 활성탄, 리그닌 및 제올라이트와 같은 다른 재료를 제조하는 데 사용할 수 있습니다[63]. 풀러렌의 제조는 소수성 특성을 증가시켜 재료를 흡착에 더 잘 적용하고 재활용을 더 쉽게 돕습니다[64]. 풀러렌 C60를 접목하여 항균 물질을 형성하는 것으로 보고되었습니다. 물 소독에 적용될 가능성이 있는 폴리비닐피롤리돈(PVP)으로. 멤브레인 기술은 물에서 염, 유기물, 입자 및 가스를 정화하는 데 점점 더 많은 관심을 받고 있습니다. 멤브레인 성능은 반응성, 선택성 및 기계적 강도를 담당하므로 재료의 구성에 따라 다릅니다. 풀러렌은 기능화의 용이성, 높은 전자 친화도, 큰 강도, 크기 조정 능력 등으로 인해 멤브레인 기술에 적용할 수 있는 강력한 잠재력을 가지고 있습니다. 풀러렌은 나노 흡착제를 접목하여 흡착 효율을 향상시키는 데 유용할 수 있습니다.
풀러렌 기반 나노물질은 생의학 응용에 활용되었으며 다양한 연구에서 생물체와의 생체적합성이 밝혀졌습니다. 생체수용체 및 바이오센서로 활용되고 있으며, 의공학에도 활용되고 있으며, 생체에 생체적합성이 있는 것으로 보고된 바 있다[65,66,67,68,69]. 풀러렌은 환경 및 수처리 응용 분야를 위한 여과, 흡착제 및 멤브레인 재료로 활용될 수 있는 무독성 물질입니다.
탄소 나노튜브는 1999년 Lijima에 의해 발견되었으며 단일벽(SWCNT)(예:적층 롤업 그래핀) 또는 다중벽 탄소 나노튜브(MWCNT)(예:다층 롤업 그래핀)일 수 있습니다[70]. CNT는 독특한 물리화학적 특성으로 인해 발견된 이후로 나노기술 연구의 초점이 되어 왔습니다. 탄소의 이러한 원통형 나노구조 동소체는 전자, 반도체, 전계 방출, 에너지 저장, 촉매 작용, 생물 의학, 공기 및 정수 필터 등에 적용되고 있습니다. 이들의 직경은 1 nm에서 수 나노미터이고 큰 비표면적(150– 1500 m 2 /g), 그들은 흡착을 통해 중금속 이온을 제거하기 위한 이상적인 후보가 되는 중간 기공을 가지고 있습니다[71, 72]. 이 외에도 CNT는 다양한 유기 분자로 쉽게 기능화될 수 있어 흡착물 선택에 특이적이 될 수 있고 흡착 능력이 향상될 수 있습니다[73]. CNT에 의한 중금속의 수착 메커니즘은 표면 특성, 전기화학적 전위 및 이온 교환 과정에 의존합니다[11, 73].
전 세계적으로 에너지 수요가 엄청나게 증가하고 있으며, 에너지 자원 재료에 대한 신뢰성 있는 기술을 위해 간단하고 경제적이며 친환경적인 재료 개발에 많은 노력을 기울이고 있습니다. 태양 에너지는 태양 전기 변환과 태양열 변환에 의해 생산됩니다[74]. 그러나 태양열 집열기의 낮은 열 변환 효율이 주요 장애물입니다.
탄소 나노유체는 태양열 흡수체로서의 우수한 성능 때문에 태양열 변환에 널리 적용되고 있다[75]. 탄소나노튜브 기반 광전지(PVC)는 이동도가 우수한 p형 반도체가 될 수 있고 전자 공여체와의 결합이 새롭고 독특한 아이디어이기 때문에 과학자들의 많은 관심을 받았다[76, 77]. 유기 광전지 소자는 고분자로 CNT를 제작함으로써 쉽게 설계할 수 있다[78]. CNT -Si(p-n) 이종접합 기반 태양전지는 우수한 전도성 및 투명 필름을 생성하도록 설계되었습니다. 이 외에도 n형 갈륨 비소(n-GaAs)를 포함하는 CNT는 녹색 레이저 및 탁상 램프에 대해 3.8%의 더 나은 효율로 보고되었습니다[79]. CNT는 또한 울트라캐패시터와 같은 전기화학적 이중층 캐패시터(EDLC)의 원리에 따라 작동하는 에너지 저장 장치로 널리 이용되었습니다[80]. 울트라커패시터의 전극에 CNT를 통합하면 300,000 이상의 주기로 수명이 크게 향상되었습니다[81]. 이 외에도 슈퍼 커패시터 CNT는 우수한 기계적 및 전기적 특성으로 인해 완벽한 p-n 접합을 만들 수 있어 기존 트랜지스터 대신 다이오드에도 활용되고 있다[58]. CNT는 또한 화학 및 바이오 센서의 감도, 선택성, 응답 시간, 비용 효율성 및 수명을 향상시킬 수 있기 때문에 고급 센서 기술에 널리 활용되었습니다[90]. 이러한 결과는 더 나은 CNT가 가장 일반적으로 적용되는 금속 기반 p형 재료의 주요 단점인 환경에 대한 부정적인 영향 없이 우수한 이동성과 더 나은 효율을 갖는 이상적인 재료임을 시사합니다.
광촉매는 반도체를 활용한 폐수 처리에 적용되는 첨단 기술 중 하나이다[82]. Fe3 등 다양한 반도체 소재가 적용되고 있습니다. O4 , ZnO 및 TiO2; 그러나 이러한 물질의 양자 효율은 높지 않으며, 이에 더하여 자외선 광 응답도 느립니다[83]. CNT는 향상된 양자 효율, 나노 크기, 높은 화학적 안정성, 중공관 구조 및 큰 비표면적으로 인한 확장된 광 흡착 영역으로 인해 촉매를 위한 유망한 고급 재료이다[84]. Gao et al. 설계된 초박형 네트워크 광촉매 기반 SWCNTs-TiO2 기름에서 물을 정화하는 데 성공적으로 적용되었습니다[85]. Park et al. SWCNT의 에어로겔에 티타니아를 장식하고 물에서 메틸렌 블루를 제거하는 데 성공적으로 적용했습니다[86]. Zhao et al. 조작된 MWCNTs-TiO2 메틸렌 블루의 광분해에 적용되었습니다[87]. Xu et al. hydroxy-MWCNT와 PbO2의 조합으로 설계된 광촉매 나노결정질 양극을 사용하여 물에서 피리딘을 제거하는 데 성공적으로 적용했습니다[88].
SWCNT는 원자 1개 두께의 벽을 가진 속이 빈 튜브로 구성된 1차원(1-D) 탄소 나노물질입니다. 이 1D 재료는 독특한 구조로 인해 탁월한 물리화학적 특성을 나타냅니다. SWCNT는 반도체, 전자, 의생명과학, 화학, 바이오센서 등 다양한 분야에서 널리 응용되고 있다[44, 89,90,91,92,93]. SWCNT는 다공성 구조, 높은 표면적, 쉬운 표면 기능화 및 나노 크기로 인해 환경 오염 제어에도 널리 사용됩니다. SWCNT의 이러한 특성은 수처리에 적용하기에 매우 유망합니다. Alijani et al. SWCNT 기반 나노복합체를 마그네타이트 코발트 설파이드로 제작하여 설계하고, 생성된 나노복합체를 수은 제거에 적용했습니다. 결과는 7분의 짧은 시간 내에 99.56% 이상의 높은 흡착을 보였다[94]. 이에 비해 SWCNT는 단독으로 45.39%의 수은을 흡착하는 것으로 밝혀졌다[94]. Anitha et al. 베어 SWCNT와 기능화된 대응물(예:SWCNTs-OH, SWCNTs-NH2)의 분자 역학 시뮬레이션을 수행했습니다. 및 중금속 이온의 흡착 용량에 대한 SWCNTs-COOH(예:Cd 2+ ) , Cu 2+ , Pb 2+ , 및 Hg 2+ 수성 매체에서. 결과는 SWCNTs-COOH가 베어 SWCNT에 비해 약 150-230% 더 높은 흡착 용량을 갖는 것으로 나타났습니다. SWCNTs-OH 및 SWCNTs-NH는 SWCNT에 비해 10-47% 더 높은 흡착을 보여 흡착에 약한 것으로 밝혀졌습니다[95]. SWCNTs-COOH는 Pb 2+ 흡착에 대해서도 보고되었습니다. , Cu 2+ , 및 CD 2+ 각각 96.02, 77.00 및 55.89 mg/g의 흡착 용량을 가진 이온. 이에 비해 기능화되지 않은 SWCNT는 Pb 2+, 에 대해 33.55, 24.29 및 24.07 mg/g을 흡착하는 것으로 나타났습니다. Cu 2+ , 및 CD 2+ 이온 [96]. Zazouli et al. l-시스테인으로 기능화하여 SWCNT 나노복합체를 설계했습니다. 그들은 물에서 수은을 제거하기 위해 설계된 나노복합체를 적용했습니다. 설계된 SWCNTs-시스테인의 흡착 효율은 95%인 것으로 밝혀졌다[97]. Gupta et al. SWCNTs-polysulfone nanocomposite 기반 멤브레인을 설계하고 중금속 제거에 적용했습니다. SWCNT의 통합은 멤브레인의 기공 크기를 감소시키고 표면을 더 매끄럽게 했습니다. 설계된 멤브레인은 금속 이온에 대해 높은 제거 능력을 나타내는 것으로 밝혀졌으며 96.8% Cr + 6 을 제거했습니다. , 87.6% As + 3 및 94.2% Pb + 2 이온. SWCNT가 없는 멤브레인은 Cr + 6 에 대해 30.3%, 28.5% 및 28.3%의 거부율을 보였습니다. , As + 3 및 Pb + 2 각각 이온. 이러한 결과는 SWCNT의 통합으로 인한 멤브레인의 효율성 향상을 보여줍니다[98]. Dehghani et al. Cr + 6 제거를 위해 SWCNT 적용 접촉 시간, 초기 pH 및 초기 Cr + 6 과 같은 다양한 매개변수의 영향을 평가합니다. 흡착 용량에 대한 이온 농도. 흡착 효율은 pH에 따라 달라지며 pH 2.5에서 최대 효율이 나타났으며 흡착은 Langmuir 등온선 모델을 따릅니다[99]. 이러한 연구는 단일벽 탄소나노튜브가 중금속으로 오염된 물의 처리에 적합하다는 것을 시사했습니다.
여러 개의 그래핀이 감긴 탄소나노튜브를 다중벽 탄소나노튜브(multiwall carbon nanotube, MWCNT)라고 한다(그림 4 참조). MWCNT는 높은 표면적, 높은 전기전도도, 높은 열전도도, 높은 인장강도 등의 독특한 특성을 보인다[100]. 이러한 물리화학적 특성 때문에 전자, 태양전지, 센서, 의생명과학 분야에 널리 응용되고 있다[101,102,103]. MWCNT는 수처리에도 널리 적용되고 있으며, 특히 중금속 이온은 MWCNT의 작용기와 화학적 상호작용에 의해 흡착된다. 산화된 MWCNT는 Cr 6+ 에 대해 높은 흡착 용량과 효율을 갖는 것으로 보고되었습니다. , Pb 2+ , 및 CD 2+ 물의 이온 [104, 105]. 금속 이온 흡착도 pH 값에 따라 달라지는데 이 성질은 pH를 변화시켜 이온을 탈착시키는 데 적용할 수 있으며 MWCNT는 재사용이 가능하다. 일부 연구에서는 플라즈마 산화된 MWCNT가 화학적으로 산화된 것보다 더 나은 흡착 특성을 가지고 있음이 밝혀졌습니다. 이것은 탄소 나노튜브의 표면에 존재하는 더 많은 수의 산소화된 작용기에 기인할 수 있습니다. 또한, 플라즈마 산화된 MWCNT는 쉽게 재활용 및 재사용될 수 있다고 보고되었습니다[72, 106].
<그림>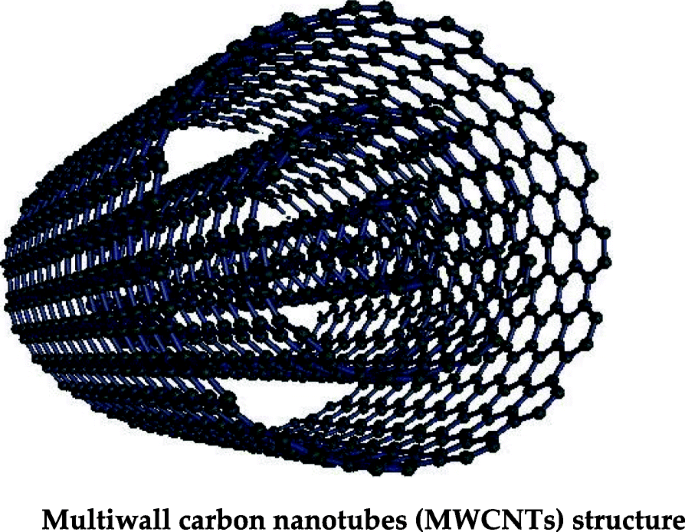
다중벽 탄소나노튜브(MWCNT) 구조
MWCNT의 복합 재료는 또한 물에서 중금속 이온을 흡착하는 데 사용되었습니다. MWCNTs-Fe2 O3 , MWCNTs-ZrO2 , MWCNTs-Fe3 O4 , MWCNTs-Al2 O3 및 MWCNTs-MnO2 -Fe2 O3 나노복합체는 Cr 6+ 의 중이온 제거에 성공적으로 적용되었습니다. , 3+ , Ni 2+ , Pb 2+ , Cu 2+ 물의 이온 [107,108,109,110]. pH 및 금속 이온 농도를 포함한 용액의 실험 조건은 MWCNT의 흡착 특성에 영향을 미칠 수 있으며 Freundlich 흡착 모델은 실험 데이터에 만족합니다[81, 111]. 기능화된 MWCNT의 흡착 효율은 유기 산화물의 다른 물질에 비해 증가되었으며, 기능화된 MWCNT는 산화되지 않은 MWCNT보다 금속 이온 흡착에 20배 더 효과적일 것으로 예측된다[112]. 일반적으로 이온의 연결과 탄소나노튜브 극성 표면의 발생이 흡착의 주요 메커니즘이라고 믿어집니다[113, 114]. 산화된 MWCNT는 또한 Pb 2+ 에 대해 예외적으로 높은 흡착 용량과 효율성을 보여주었습니다. , CD 2+ 및 Cr 6+ 물에서. 산 처리된 MWCNT의 수착 효율은 표면에 이온 착물 또는 염 침전물을 만드는 산소 작용기와 함께 납, 크롬 및 카드뮴 이온을 제거할 가능성을 증가시킵니다[115]. 농축 HNO3로 처리된 MWCNT의 흡착 increases significantly mainly due to oxygen functional groups created on the surface of acidified nanotubes that can react with metal ions to form complex or salt precipitates on the surface. The MWCNT composites with certain compounds like iron (III) oxide, zinc oxide, and aluminum oxide are formed by a coprecipitation method, and resulting composites are successfully applied for the removal of chromium, nickel, lead, copper, and arsenic ions. The adsorption efficiency of these nanocomposites was found to be dependent on the pH value and temperature, and the sorption process can be accomplished by changing these parameters [116, 117]. Depending on the pH and temperature, the sorption capacity of these composites varied from 10 to 31 mg/g. The adsorption process for these nanocomposites was well described by the Langmuir model [118]. The nanocomposites of oxidized multiwalled MWCNTs with manganese oxide/iron (III) oxide are reported to remove Cr 6+ ions with maximum adsorption capacity of 186.9 mg/g with the maximum removal capacity of 85% at the optimum pH 2.1 studies. Their promising adsorption was due to the surface polarity of the adsorbents. It has also been reported that plasma-oxidized MWCNTs are better in adsorption compared to chemically oxidized ones as the prior ones have more oxygenated functional groups [119]. Plasma-oxidized technique has also been reported for the formation of nanotubes with titanium oxide and manganese dioxide and utilized for the removal of lead ions from water. The results showed that these hybrid systems can act as an effective adsorbent for the lead ions in the first case; the adsorption capacity was 137 mg/g, and in the second case, it was 78.74 mg/g [120]. In a heterogeneity adsorbent surface, sites combined twice are fitted in the isotherms models of the Langmuir-Freundlich equation that was used to differentiate between two types of adsorption sites with greater and lesser energy affinities for the Ni 2+ ions [121]. It is believed that nickel ion sorption mainly occurs at the sites of energy with modified nanocomposites of MWCNTs and the nano-modification leads to a 20% increase in the adsorption capacity at small (up to 0.1 mol/l) equilibrium adsorbate concentrations. Another modification reported for MWCNTs is their functionalization with hydroxyquinoline and their application for the removal of copper, lead, cadmium, and other toxic ions [122]. The carbon nanotubes alone as well as in their oxidized and in their composite forms have tremendous ability to adsorb the heavy metal ions, and a lot of research is in progress for their applications in purification of water. Elsehly et al. applied commercial MWCNTs for the removal of the manganese and iron which could reach 71.5% and 52% respectively with a concentration in aqueous solution of 50 ppm of these metal ions [123]. In another study, CNT-based nanocomposites have been applied for the removal iron and manganese from the water [124].
Carbon nanotubes have great potential to be applied for multidisciplinary fields like drug delivery, diagnosis, biosensors, electronics, semiconductors, and environmental remediations [125]. Different studies revealed the biocompatibility of CNTs as it has been widely exploited for biomedical applications [126, 127]. Carbon-based materials like CNTs are safe to be applied for the environmental remediation and in particularly for water treatment.
Graphene Based Material for Environmental Remediation
Graphene-based material for the adsorption of gaseous contaminants
Carbon dioxide (CO2 ) has been the environmental concern because of its immense effect in global warming [128]. Nanomaterials have been found to be promising materials as compared to conventional materials both with respect to cost and efficiency [129]. Graphene-based materials have been utilized for the adsorption of gaseous contaminants [130]. Gosh et al. showed the successful application of graphene-based nanomaterials for the capture of CO2 및 H2 . A single layer of graphene has been reported to capture 37.93% of CO2 [130]. Graphene has been reported to selectively adsorb CO2 as compared to methane (CH4 ) and nitrogen (N2 ) gases. Selectivity of graphene oxide (GO) for CO2 can be attributed to higher dipole moment of carbon dioxide which can easily interact with polar oxygenated functional groups of CO2 [74, 131]. Other studies have also been reported for tuning the graphene chemistry for the improved selectivity of the desired gaseous contaminant [75, 131].
Graphene Oxide in Removal of Organic Dyes from Water
Graphene-based nano-adsorbents are excellent advanced materials for the removal of the organic contaminants from the water because of their nano-scaled size, high surface area, ability to interact via pi-pi stacking, hydrogen bonding, and electrostatic interactions [26]. In comparative adsorption studies of GO and graphite using methylene blue and malachite green as standard organic dyes, it was found that GO showed much better adsorption than graphite [26]. GO has also been utilized for the removal of cationic dyes namely methylene blue (MB), crystal violet (CV), and rhodamine B (RhB) from water. It was found that the higher the initial dye concentration, the higher will be the adsorption with adsorption capacities of 199.2, 195.4, and 154.8 mg g −1 for MB, CV, and RhB, respectively [76]. GO has also successfully applied for the removal of anionic dyes like Acid Orange 8 (AO8) and Direct Red 23 (DR23) from aqueous solutions [77].
Graphene-Based Photocatalytic Materials for Water Decontamination
Although adsorption can remove the contaminant from water, the adsorption technique is unable to destroy/degrade the contaminants and disposal step is required [77]. Photocatalysis is a useful approach for water remediation/wastewater treatment for the complete degradation and mineralization of organic/biological contaminants [78]. Graphene-based photocatalysts have been reported for their improved activity because of their high surface area, nanosize, and more electronic movements as compared to the traditionally used materials [78, 132]. Rommozzi et al. designed reduced graphene oxide (rGO) with a greener reduction method using glucose and ammonium hydroxide and successfully designed a photocatalyst which is visible by the fabrication with TiO2 . The designed rGO-TiO2 photocatalyst was successfully applied for the refractory dye named Alizarin Red S (ARS) [133]. In other studies, graphene oxide fabricated with TiO2 and ZnO exhibited much photodegradation of methylene blue as compared to TiO2 /ZnO alone [79, 80].
Graphene is one-atom-thick-layered hexagonal lattice of carbon atoms and is known as the thinnest material with the strength of 200 times than steel. Graphene was discovered in 2004 by Sir Andre Geim and Sir Konstantin Novoselov, who were awarded a Nobel prize for their discovery in 2010. Graphene (2-D) is being used widely in almost every field such as in touch screens, mobiles, LCDs, semiconductors, computer chips, batteries, energy generation, water filters, supercapacitors, solar cells, and biomedical and environmental sciences [134,135,136,137]. These 2-D graphene-based materials are getting more and more attention in water treatment due to their unique physicochemical characteristics namely electronic properties, high surface area, thermal mobility, high mechanical strength, and tunable surface chemistry [118, 134, 138, 139]. Tabish et al. designed porous graphene and applied it as an adsorbent for the removal of heavy metal ions as well as other pollutants from water. They applied this porous graphene material for As 3+ removal from water and found 80% efficiency. The material was found to retain its water treatment properties after regeneration and recycling [138]. Guo et al. designed a nanocomposite of partially reduced graphene oxide by its fabrication with Fe3 O4 via in situ co-precipitation method and applied it for the removal of Pb 2+ ions from water. The designed nanocomposite was found to be excellent in removing the Pb 2+ ions from aqueous solution with an adsorption capacity of 373.14 mg/g [140]. Zhang et al. functionalized the reduced graphene oxide with 4-sulfophenylazo (rGOs) and applied it for the removal of a variety of heavy metal ions from aqueous solution. The designed material showed the maximum adsorption capacity of 689, 59, 66, 267, and 191 mg/g for the Pb 2+ , Cu 2+ , Ni 2+ , CD 2+ , and Cr 3+ respectively [141]. Diana et al. designed a graphene-based self-propelled microbot system whose structure was made up of nanosized multilayered consisting of graphene oxide, nickel, and platinum. Each layer performed a different function, e.g., graphene oxide captures the heavy metal Pb 2+ ions, the middle layer of Ni enables the control of microbots with the help of external magnetic field, and the inner layer of platinum helps the engine in self-propelling [142]. The designed system was found to remove the 80% of the Pb 2+ water solution. Figure 5 shows the schematic illustration of the working principle of microbots. Yang et al. designed hydrogen beads using graphene oxide and sodium alginate (GO-SA) and successfully applied them for the removal of Mn 2+ ions from the aqueous solution with excellent adsorption capacity of 56.49 mg/g [9]. Zheng et al. designed nanocomposites by fabrication of zinc oxide with tea polyphenol with reduced graphene oxide (TPG-ZnO). Designed material was applied for the removal of heavy metal ions with an added advantage of antibacterial properties [143]. They applied this material for the removal of Pb 2+ ions from aqueous solution with adsorption efficiency of 98.9%, and the adsorbent was found to possess antibacterial properties against Streptococcus mutans with 99% eradication [143]. Mousavi et al. designed nanocomposites of graphene oxide with iron oxide magnetite nanoparticles Fe3 O4 and applied them for the removal of Pb 2+ ions from water and the material showed 98% removal efficiency with a capacity of 126.6 mg/g [144]. Considering functionalized graphene as an adsorbent to remove Pb 2+ ions from an aqueous medium, the highest record of Pb 2+ ion removal over graphene is 406.6 mg/g at pH of 5.0 in 40 min [145]. Graphene-hydrogel lingo sulfonate functionalized nanocomposites having oxygenated functional groups making the surface highly polar reported to increase the rate of adsorption of Pb 2+ ions with maximum efficacy of 1308 mg/g with the equilibrium reached in 40 min. Awad et al. modified graphene oxide with chloroacetic acid (GO-COOH) and ethylenediamine (GO-amino). The designed systems were applied for the removal of mercury (Hg 2+ ) from water and found that the nanocomposites (GO-COOH) and (GO-amino) have an adsorption capacity of 122 mg/g and 230 mg/g. In addition to this, designed systems retained their adsorption efficiency after the recycling process [146]. Yanet al. designed magnet graphene oxide for the rapid removal and separation of Fe (II) and Mn (II) from micropolluted water [147]. Ali et al. designed graphene-based adsorbent successfully for the removal of noxious pollutants namely Cu (II), Pb (II), Fe (II), and Mn (II) [148].
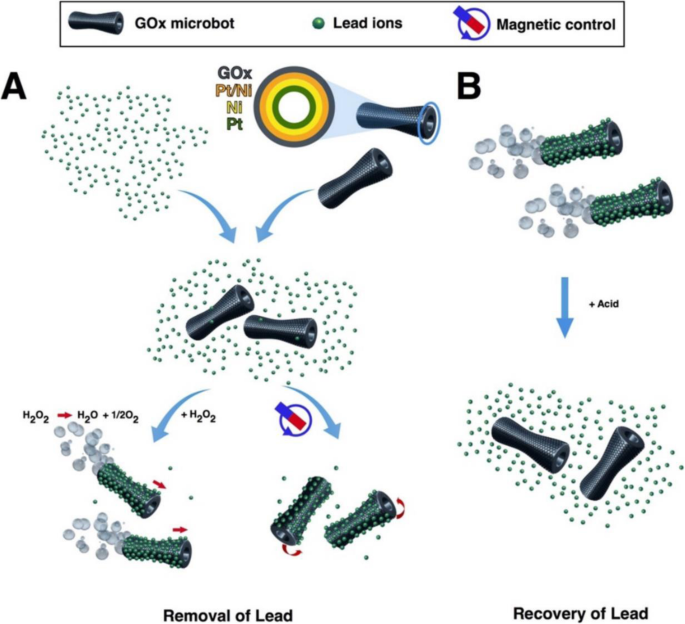
Scheme of GOx-microbot-based approach for lead decontamination and recovery. 아 Decontamination of polluted water using GOx-microbots fabricated by electrodeposition of nanolayers of graphene oxide (GOx), Pt/Ni layer, Ni magnetic layer, and Pt catalytic inner layer. The decontamination strategy for lead ions can be carried out by two different techniques:self-propulsion of the GOx-microbots in the presence of H2 O2 or by using an external rotating magnetic field. ㄴ Recovery of lead ions from the GOx-microbots in the presence of acidic media [117]
Graphene-based nanomaterials have been applied in different fields like electronics, chemical sensors, biosensors, drug delivery, theragnostic, and other related biomedical fields. These studies also report the cytocompatibility of graphene-based materials both by in vitro as well as in vivo animal studies [122, 133, 149,150,151,152]. These findings suggest that the graphene-based materials are safe for the environmental remediation application as they are just used for the removal and degradation of pollutants and are not consumed by humans directly.
Activated carbon is a fabulous material because of its high surface area, highly porous structure, and ease of preparation with variety of starting materials. Because of its ideal physicochemical properties, it has wide application in environmental remediations in different industries like pharmaceutics, fertilizer plants, petroleum, cosmetics, automobiles, and textiles [153] It is also widely applied for the adsorption of gases, solvent recovery, and wastewater treatment especially for the removal of organic dyes/other pollutants; not only this, but it is also used as a catalyst in biodiesel production. It is also applied as a low-cost material for the treatment and removal of water containing COD, BOD, and TSS and stabilizing and maintaining the optimum pH for biological uses [154,155,156]. Maguana et al. prepared activated carbon from the pear seed cake and successfully applied it for the removal of methylene having an adsorption capacity of 260 mg/g [157]. Antonio et al. prepared activated carbon from the kenaf plant and applied it successfully for the treatment of the wastewater of hospitals containing paracetamol as the main pollutant [158]. The above literature suggests that the activated carbon is the pretty useful economical material which can easily be prepared and it has immense application in environmental remediations.
Activated carbon (AC) is also known as activated charcoal, and this of type carbon material is formed under some treatment protocols resulting in micro/nanopores and having the large surface area of more than 3000 m 2 [159]. The AC is produced on a large scale from coal, wood, and agricultural wastes [160]. In addition to its porous nature (as shown in Fig. 6), AC also has a high mechanical strength which enables its applications in catalyst support, capacitors, electrodes, and gas storage and most importantly used as the adsorbent for removal of metal ions, organic wastes, and gases from water [160,161,162]. The high mechanical strength of activated carbon enables its periodic cleaning, regeneration, and reutilization [160]. Abeer et al. reported the preparation of AC from apricot stone and its application in removal of Zn + 2 and Al + 3 ions with removal efficiency of 92% [163]. Ebrahim et al. designed AC from sewage sludge, applied it for the removal of Cu + 2 ions from water, and found that the designed material showed maximum adsorption capacity of above 50% [164].
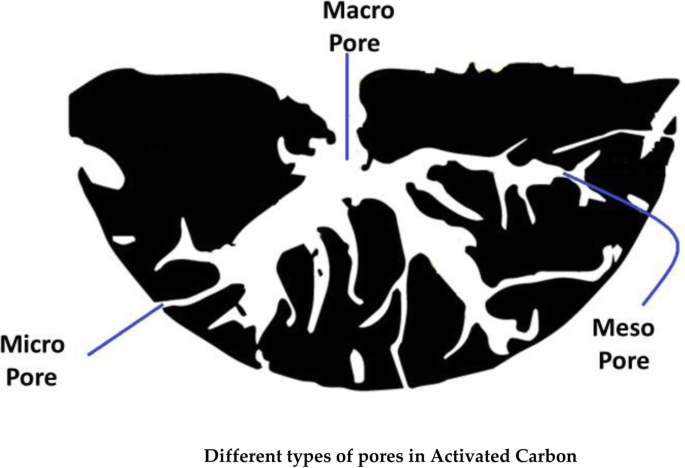
Different types of pores in activated carbon
Li et al. prepared the AC from sewage sludge produced from the wastewater treatment plant and functionalized it with sulfur [165]. They applied sulfonated AC for the removal of Pb 2+ , CD 2+ , Cu 2+ , and Ni 2+ ions from water. The adsorption capacity of metal ions were found to be 238.1 mg/g, 96.2 mg/g, 87.7 mg/g, and 52.4 mg/g for Pb 2+ , CD 2+ , Cu 2+ , and Ni 2+ respectively [165]. Cao et al. designed multipore activated carbon (MPAC) with a large surface area using the agricultural waste of long-root Eichhornia crassipes and applied it for removing heavy metal ions, e.g., Pb 2+ , CD 2+ , Cu 2+ , Ni 2+ 및 Zn 2+ . They found that at 30 °C adsorption capacity being 1.34 mmol/g, 1.07 mmol/g, 1.22 mmol/g, 0.97 mmol/g, and 0.93 mmol/g for Pb 2+ , CD 2+ , Cu 2+ , and Ni 2+ respectively [166]. Donget al. investigated the application of spent activated carbon (AC) for heavy metal ion removal from water and found high adsorption capacity of 95% and 86% for Pb 2+ and Cd 2+ ions respectively [167]. M. Bali et al. [168] applied commercial AC for the removal of heavy metal ions and found that adsorption equilibrium of Cd 2+ ion took 15 min while for Pb 2+ , Zn 2+ , and Cu 2+ it took 45 min with percentage removal of 64% for all these ions and with Cd 2+ being the highest [10]. Kongsuwan et al. prepared the activated carbon from the agricultural waste of eucalyptus bark. They applied it for the removal of Cu 2+ 및 Pb 2+ from water with maximum removal capacity of 0.45 and 0.53 mmol per gram of AC respectively, with adsorption being the main mechanism of ion uptake [169]. AC poultry litter has also been reported and applied for the treatment of heavy metal-contaminated water and found that for 1 kg of poultry litter AC adsorbs 404 mmol, 945 mmol, 236 mmol, and 250–300 mmol of Cu 2+ , Pb 2+, Zn 2+ , and Cd 2+ ions respectively [170]. This adsorption is significantly higher than the commercially available AC derived from coconut and bituminous. The AC of wood saw dust of rubber plant has also been reported for the removal of heavy metal ions of Cr + 6 from water with adsorption capacity of 44 mg/g [171]. AC formed from Moso and Ma bamboo was found to be highly efficient in removing the heavy metal ions, i.e., Pb 2+, Cu 2+ , Cr 3+ , and Cd 2+ with the maximum adsorption capacity of more than 90% removal [172]. Naser et al. prepared AC from rice husk and applied them for the removal of Cu 2+ from aqueous solution, and maximum capacity was found to be 33.92%. Similar results have also been reported for the removal of Cu 2+ from the AC formed from Palm shell [173]. AC of love stones has been reported for the adsorption of Cd + 2 and Ni + 2 with adsorption capacity of 1.85 mg/g and 0.67 mg/g respectively in two different studies [174, 175]. AC prepared from olive stone using the microwave method has been applied for the removal of Fe 2+, Pb 2+, Cu 2+, Zn 2+, Ni 2+ , and Cd 2+. from wastewater. Another study reported on the olive stone AC prepared via microwave to remove a group of metal ions from synthetic wastewater:Fe 2+ , Pb 2+ , Cu 2+, Zn 2+ , Ni 2+ , and Cd 2+ with removal efficiency of more than 98% [176]. Tamarind wood AC has been reported for the highest adsorption capacity of above 97% for Pb 2+ from water [177]. Activated carbon has been applied as an adsorbent for the removal of Fe (II) and Mn (II) with great efficiency [178, 179]. The activated carbon is easy to synthesize, is cheaper, and is the most promising material for the adsorption of heavy metal ions and can be prepared at a large scale from a variety of carbon sources especially form agricultural waste. In addition to easier preparation, AC can easily be functionalized. Table 2 summarizes the effect of different parameters on the process of metal ion adsorption.
Different studies have been conducted for the biocompatibility evaluation of the activated carbon materials prepared form different carbon sources. Activated carbon has been applied for the treatment of cystitis and was found to be effective and nontoxic compared to the antibiotics being applied [180]. Biocompatibility of activated carbon can be attributed to its inertness, and it has also been functionalized and fabricated with other materials to confer on the disinfection properties [181]. The activated carbon is also given orally to human beings as a sorbent for the removal of toxins from the human body and has also been utilized in biomedical applications [182, 183]. These studies strongly suggest the biocompatibility of the activated carbon.
In this review, environmental and special purification of heavy metal from heavy metal contaminants by the applications of carbon nanomaterials, namely fullerene carbon nanotubes, graphene, graphene oxide, and activated carbon discussed. These carbon nanomaterials have been utilized in the purification of heavy metal-contaminated water with great success. The reason behind the successful application is due to their fascinating properties like high surface area, ease of recycling, and easiness to desorb the adsorbed metal ions; only using mineral acid solution and regenerated material can be reused with retention of adsorption capability. In addition to these properties, the carbon nanomaterials can easily be fabricated with other nanomaterials and are easy to be functionalized resulting in multifunctional nano-adsorbent. Carbon-based materials are highly biocompatible with living organisms and environment. There is also an immense effect of different parameters such as pH, contact time, and type of adsorbents on the process of metal ion adsorption. Based on this literature review, it can be concluded that carbon nanomaterials have fascinating physicochemical properties and have great potential to be exploited in the environmental remediation and water purification.
모든 데이터는 제한 없이 완전히 사용할 수 있습니다.
Activated carbon
산화 그래핀
Multiwall carbon nanotubes
환원그래핀옥사이드
Single-wall carbon nanotubes
나노물질
폐수 및 수처리 기술 값싸고 풍부한 물은 수세기 동안 철강 산업이 당연하게 여겼던 생산 유틸리티였습니다. 그러나 현재 시나리오에서는 담수 가용성과 소비 간의 불균형이 증가함에 따라 수자원이 점점 부족해지고 있으며, 이에 따라 깨끗하고 안전한 물에 대한 접근은 현대 사회의 주요 과제 중 하나가 되었습니다. 물 수요는 (i) 인구 증가 및 가뭄 취약 지역으로의 이동, (ii) 급속한 산업 발전 및 1인당 물 사용량 증가, (iii) 인구 밀집 지역의 기상 패턴 변화로 이어지는 기후 변화로 인해 계속 증가하고 있습니다. 이로 인해 철
탄소 섬유 (CF)는 직경이 약 5-10마이크로미터이고 대부분 탄소 원자로 구성된 섬유입니다. 탄소 섬유에는 몇 가지 장점이 있습니다. 높은 강성 , 높은 인장 강도 , 저중량 그리고 높은 내화학성 . 이 게시물을 읽고 나면 주요 분류를 알게 될 것입니다. 탄소 섬유의 원료 자세한 제조 프로세스에 대해 알아보세요. 즉, 탄소 섬유 제품의 품질을 빠르게 구별하고 전체 제조 공정을 보다 효율적으로 파악할 수 있습니다. 1. 탄소 섬유의 일반 분류 아. 인장 계수 기준 인장 계수 탄소 섬유를 분류하는 핵심 기준은 섬유입